Vivencia Patch (Bula do profissional de saúde)
Aché Laboratórios Farmacêuticos S.A
IDENTIFICAÇÃO DO MEDICAMENTO
Vivencia Patch
rivastigmina
Adesivos transdérmicos
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Adesivos transdérmicos 5 cm², 10 cm² e 15 cm²
Embalagens contendo 7, 15 ou 30 adesivos
USO TRANSDÉRMICO
USO ADULTO
COMPOSIÇÃO:
Cada adesivo transdérmico de 5 cm² de Vivencia Patch contém 9 mg de rivastigmina, cujo percentual de liberação é de 4,6 mg/24 h.
Cada adesivo transdérmico de 10 cm² de Vivencia Patch contém 18 mg de rivastigmina, cujo percentual de liberação é de 9,5 mg/24 h.
Cada adesivo transdérmico de 15 cm² de Vivencia Patch contém 27 mg de rivastigmina, cujo percentual de liberação é de 13,3 mg/24 h.
Excipientes: acrilato de etil-hexila, acrilato de metila, ácido acrílico, metacrilato de butila, metacrilato de metila e sílica metilada trimetilada.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE1
INDICAÇÕES
Tratamento de pacientes com demência2 leve a moderadamente grave do tipo Alzheimer3, também conhecida como doença de Alzheimer4 provável ou doença de Alzheimer4.
Tratamento de pacientes com demência2 leve a moderadamente grave associada à doença de Parkinson5.
RESULTADOS DE EFICÁCIA
Estudos clínicos na doença de Alzheimer4
A eficácia da rivastigmina adesivos transdérmicos 10 e 15 cm2 em pacientes com demência2 leve a moderadamente grave do tipo Alzheimer3 foi demonstrada em um estudo duplo-cego6, placebo7 controlado de 24 semanas e na sua fase aberta de extensão e um estudo comparativo, duplo-cego, ativo de 48 semanas.
Demência2 leve a moderada de Alzheimer3 Estudos controlados de 24 semanas
Os pacientes envolvidos em um estudo placebo7 controlado tiveram um MEEM (Mini Exame do Estado Mental) de 10 - 20. A eficácia foi estabelecida através do uso de instrumentos independentes de avaliação e de domínio específico, os quais foram aplicados a intervalos regulares durante o período de 24 semanas de tratamento. Isso inclui o ADAS-Cog (uma medida de cognição8 baseada no desempenho), o ADCS-CGIC (uma avaliação global compreensiva do paciente pelo médico envolvendo os dados do cuidador) e o ADCS-ADL (uma avaliação medida pelo cuidador sobre as atividades do cotidiano incluindo higiene pessoal, alimentação, vestir-se, tarefas domésticas tais como compras, retenção da habilidade para se orientar no ambiente tão bem quanto o envolvimento em atividades relacionadas a finanças). Os resultados de 24 semanas para os três instrumentos de avaliação estão resumidos na Tabela 11,2,3.
Tabela 1: Resultados de 24 semanas para as três ferramentas de avaliação em pacientes com demência2 por doença de Alzheimer4 leve a moderada
|
População ITT-LOCF |
Rivastigmina 10 cm² |
Rivastigmina 20 cm² |
Rivastigmina cápsula 12 mg/dia |
Placebo7 |
|
ADAS – Cog Linha de base ± DP Alteração média na semana 24 ± DP Valor p vs placebo7 |
(n=248) 27,0 ± 10,3 -0,6 ± 6,4 0,005*¹ |
(n=262) 27,4 ± 9,7 -1,6 ± 6,5 <0,001*¹ |
(n=253) 27,9 ± 9,4 -0,6 ± 6,2 0,003*¹ |
(n=281) 28,6 ± 9,9 1,0 ± 6,8
|
|
ADCS – CGIC População média ± DP Valor p vs placebo7 |
(n=248) 3,9 ± 1,20 0,010*2 |
(n=260) 4,0 ± 1,27 0,054*2 |
(n=253) 3,9 ± 1,25 0,009*2 |
(n=278) 4,2 ± 1,26
|
|
ADCS - ADL Linha de base ± DP Alteração média na semana 24 ± DP Valor p vs placebo7 |
(n=247) 50,1 ± 16,3 -0,1 ± 9,1 0,013*2 |
(n=263) 47,6 ± 15,7 0,0 ± 11,6 0,017*2 |
(n=254) 49,3 ± 15,8 -0,5 ± 9,5 0,39*2 |
(n=281) 49,2 ± 16,0 -2,3 ± 9,4
|
* p ≤ 0,05 vs placebo7
ITT: Intent-To-Treat; LOCF: Last Observation Carried Forward.
1 Baseado em ANCOVA com o tratamento e o país como fatores e o valor de linha de base como uma covariante. As alterações negativas do ADAS-Cog indicam melhora. As alterações positivas do ADCS-ADL indicam melhora.
2 Baseado no teste CMH (teste van Elteren) por país. As pontuações ADCS-CGIC < 4 indicam melhora.
Os resultados para respostas clinicamente relevantes do estudo de 24 semanas são apresentados na Tabela 2. Evoluções clinicamente relevantes foram definidas a priori como: melhora de pelo menos 4 pontos no ADAS-Cog, ausência de piora no ADCS-CGIC e ausência de piora no ADCS-ADL 1,2.
Tabela 2: Resultados para respostas clinicamente relevantes do estudo placebo7 controlado de 24 semanas em pacientes com demência2 por doença de Alzheimer4 leve a moderada
|
|
Pacientes com respostas clinicamente significantes (%) |
|||
|
Rivastigmina 10 cm² |
Rivastigmina 20 cm² |
Rivastigmina cápsula 12 mg/dia |
Placebo7 |
|
|
Melhora de pelo menos 4 pontos no ADAS-Cog com ausência de piora no ADCS-CGIC e no ADCS-ADL |
17,4 * |
20,2 ** |
19,0** |
10,5 |
* p < 0,05, ** p < 0,01 vs placebo7
Resultados similares foram observados com rivastigmina adesivos transdérmicos 10 cm² em estudos controlados realizados separadamente em pacientes chineses e japoneses, com demência2 de Alzheimer3 leve a moderadamente grave.
Estudo comparativo ativo controlado de 48 semanas4
Pacientes envolvidos no estudo comparativo ativo controlado, tinham uma linha de base inicial de pontuação MEEM (Mini Exame do Estado Mental) de 10-24. O estudo foi desenhado para comparar a eficácia de rivastigmina adesivos transdérmicos 15 cm² vs rivastigmina adesivos transdérmicos 10 cm² durante uma fase de tratamento duplo-cego de 48 semanas em pacientes com demência2 por doença de Alzheimer4, que demonstrou declínio funcional e cognitivo9 após as 24-48 iniciais do tratamento de fase aberta, enquanto manteve a dose de rivastigmina adesivos transdérmicos 10 cm². O declínio funcional foi avaliado pelo investigador e o declínio cognitivo9 foi definido como uma diminuição na pontuação no MEEM > 2 pontos em relação à visita anterior ou um decréscimo ≥ 3 pontos da linha de base. A eficácia foi estabelecida pelo uso independente, ferramentas de domínio específico de avaliação que foram aplicadas em intervalos regulares durante o período de tratamento de 48 semanas. Estas incluem a ADAS-Cog (uma medida de desempenho baseada em cognição8) e a ADCS-ADL instrumental (uma subescala das atividades ADCS-ADL de escala da vida diária que avalia as atividades instrumentais que são pensadas para envolver as mais complexas atividades cognitivas que representam clinicamente significativas atividades funcionais da vida diária, que incluem manutenção financeira, preparação de refeições, compras, capacidade de orientar-se ao ambiente, capacidade de serem deixados sozinhos, etc)4. Os resultados de 48 semanas para as duas ferramentas de avaliação estão resumidos na Tabela 3.
Tabela 3: Alteração média nas pontuações de ADAS-Cog e ADCS-IADL da linha de base duplo-cego ao longo do tempo em pacientes com demência2 por doença de Alzheimer4 leve a moderada.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE1
INDICAÇÕES
Tratamento de pacientes com demência2 leve a moderadamente grave do tipo Alzheimer3, também conhecida como doença de Alzheimer4 provável ou doença de Alzheimer4.
Tratamento de pacientes com demência2 leve a moderadamente grave associada à doença de Parkinson5.
RESULTADOS DE EFICÁCIA
Estudos clínicos na doença de Alzheimer4
A eficácia da rivastigmina adesivos transdérmicos 10 e 15 cm2 em pacientes com demência2 leve a moderadamente grave do tipo Alzheimer3 foi demonstrada em um estudo duplo-cego6, placebo7 controlado de 24 semanas e na sua fase aberta de extensão e um estudo comparativo, duplo-cego, ativo de 48 semanas.
Demência2 leve a moderada de Alzheimer3 Estudos controlados de 24 semanas
Os pacientes envolvidos em um estudo placebo7 controlado tiveram um MEEM (Mini Exame do Estado Mental) de 10 - 20. A eficácia foi estabelecida através do uso de instrumentos independentes de avaliação e de domínio específico, os quais foram aplicados a intervalos regulares durante o período de 24 semanas de tratamento. Isso inclui o ADAS-Cog (uma medida de cognição8 baseada no desempenho), o ADCS-CGIC (uma avaliação global compreensiva do paciente pelo médico envolvendo os dados do cuidador) e o ADCS-ADL (uma avaliação medida pelo cuidador sobre as atividades do cotidiano incluindo higiene pessoal, alimentação, vestir-se, tarefas domésticas tais como compras, retenção da habilidade para se orientar no ambiente tão bem quanto o envolvimento em atividades relacionadas a finanças). Os resultados de 24 semanas para os três instrumentos de avaliação estão resumidos na Tabela 11,2,3.
Tabela 1: Resultados de 24 semanas para as três ferramentas de avaliação em pacientes com demência2 por doença de Alzheimer4 leve a moderada
|
População ITT-LOCF |
Rivastigmina 10 cm² |
Rivastigmina 20 cm² |
Rivastigmina cápsula 12 mg/dia |
Placebo7 |
|
ADAS – Cog Linha de base ± DP Alteração média na semana 24 ± DP Valor p vs placebo7 |
(n=248) 27,0 ± 10,3 -0,6 ± 6,4 0,005*¹ |
(n=262) 27,4 ± 9,7 -1,6 ± 6,5 <0,001*¹ |
(n=253) 27,9 ± 9,4 -0,6 ± 6,2 0,003*¹ |
(n=281) 28,6 ± 9,9 1,0 ± 6,8
|
|
ADCS – CGIC População média ± DP Valor p vs placebo7 |
(n=248) 3,9 ± 1,20 0,010*2 |
(n=260) 4,0 ± 1,27 0,054*2 |
(n=253) 3,9 ± 1,25 0,009*2 |
(n=278) 4,2 ± 1,26
|
|
ADCS - ADL Linha de base ± DP Alteração média na semana 24 ± DP Valor p vs placebo7 |
(n=247) 50,1 ± 16,3 -0,1 ± 9,1 0,013*2 |
(n=263) 47,6 ± 15,7 0,0 ± 11,6 0,017*2 |
(n=254) 49,3 ± 15,8 -0,5 ± 9,5 0,39*2 |
(n=281) 49,2 ± 16,0 -2,3 ± 9,4
|
* p ≤ 0,05 vs placebo7
ITT: Intent-To-Treat; LOCF: Last Observation Carried Forward.
1 Baseado em ANCOVA com o tratamento e o país como fatores e o valor de linha de base como uma covariante. As alterações negativas do ADAS-Cog indicam melhora. As alterações positivas do ADCS-ADL indicam melhora.
2 Baseado no teste CMH (teste van Elteren) por país. As pontuações ADCS-CGIC < 4 indicam melhora.
Os resultados para respostas clinicamente relevantes do estudo de 24 semanas são apresentados na Tabela 2. Evoluções clinicamente relevantes foram definidas a priori como: melhora de pelo menos 4 pontos no ADAS-Cog, ausência de piora no ADCS-CGIC e ausência de piora no ADCS-ADL 1,2.
Tabela 2: Resultados para respostas clinicamente relevantes do estudo placebo7 controlado de 24 semanas em pacientes com demência2 por doença de Alzheimer4 leve a moderada
|
|
Pacientes com respostas clinicamente significantes (%) |
|||
|
Rivastigmina 10 cm² |
Rivastigmina 20 cm² |
Rivastigmina cápsula 12 mg/dia |
Placebo7 |
|
|
Melhora de pelo menos 4 pontos no ADAS-Cog com ausência de piora no ADCS-CGIC e no ADCS-ADL |
17,4 * |
20,2 ** |
19,0** |
10,5 |
* p < 0,05, ** p < 0,01 vs placebo7
Resultados similares foram observados com rivastigmina adesivos transdérmicos 10 cm² em estudos controlados realizados separadamente em pacientes chineses e japoneses, com demência2 de Alzheimer3 leve a moderadamente grave.
Estudo comparativo ativo controlado de 48 semanas4
Pacientes envolvidos no estudo comparativo ativo controlado, tinham uma linha de base inicial de pontuação MEEM (Mini Exame do Estado Mental) de 10-24. O estudo foi desenhado para comparar a eficácia de rivastigmina adesivos transdérmicos 15 cm² vs rivastigmina adesivos transdérmicos 10 cm² durante uma fase de tratamento duplo-cego de 48 semanas em pacientes com demência2 por doença de Alzheimer4, que demonstrou declínio funcional e cognitivo9 após as 24-48 iniciais do tratamento de fase aberta, enquanto manteve a dose de rivastigmina adesivos transdérmicos 10 cm². O declínio funcional foi avaliado pelo investigador e o declínio cognitivo9 foi definido como uma diminuição na pontuação no MEEM > 2 pontos em relação à visita anterior ou um decréscimo ≥ 3 pontos da linha de base. A eficácia foi estabelecida pelo uso independente, ferramentas de domínio específico de avaliação que foram aplicadas em intervalos regulares durante o período de tratamento de 48 semanas. Estas incluem a ADAS-Cog (uma medida de desempenho baseada em cognição8) e a ADCS-ADL instrumental (uma subescala das atividades ADCS-ADL de escala da vida diária que avalia as atividades instrumentais que são pensadas para envolver as mais complexas atividades cognitivas que representam clinicamente significativas atividades funcionais da vida diária, que incluem manutenção financeira, preparação de refeições, compras, capacidade de orientar-se ao ambiente, capacidade de serem deixados sozinhos, etc)4. Os resultados de 48 semanas para as duas ferramentas de avaliação estão resumidos na Tabela 3.
Tabela 3: Alteração média nas pontuações de ADAS-Cog e ADCS-IADL da linha de base duplo-cego ao longo do tempo em pacientes com demência2 por doença de Alzheimer4 leve a moderada.
|
População visitada |
rivastigmina adesivos transdérmicos 15 cm² |
rivastigmina adesivos transdérmicos 10 cm² |
rivastigmina adesivos transdérmicos 15 cm² |
||||
|
ADAS Cog
LOCF |
Linha de base |
Média |
Média |
DLSM |
95% CI |
Valor – p |
|
|
(n=264) |
(n=268) |
|
|
|
|||
|
34,4 |
34,9 |
||||||
|
Duplo-cego |
Valor |
35,4 |
37,1 |
|
|
|
|
|
Variação |
1,0 |
2,2 |
-1,3 |
(-2,5, -0,2) |
0,027* |
||
|
Duplo-cego semana 48 |
Valor |
38,5 |
39,7 |
|
|
|
|
|
Variação |
4,1 | 4,9 | -0,8 | (-2,1, 0,5) | 0,227 | ||
|
ADAS Cog
LOCF |
Linha de base |
(n=265) |
(n=271) |
|
|
|
|
|
27,5 |
25,8 |
||||||
|
Duplo-cego |
Valor |
26,0 |
22,9 |
|
|
|
|
|
Variação |
-1,5 |
-2,8 |
1,7 |
(0,5, 2,9) |
0,005* |
||
|
Duplo-cego semana 48 |
Valor |
23,1 |
19,6 |
|
|
|
|
|
Variação |
-4,4 | -6,2 | 2,2 | (0,8, 3,6) | 0,002* | ||
ANCOVA - análise de covariância, IC - intervalo de confiança, DB - duplo-cego.
DLSM - diferença nos valores mínimos, LOCF - última observação levada adiante.
Pontuações ADAS-Cog: A diferença negativa em DLSM indica uma maior melhoria com rivastigmina adesivos transdérmicos 15 cm2 em comparação com rivastigmina adesivos transdérmicos 10 cm2.
Pontuações ADCS-IADL: A diferença positiva na DLSM indica uma maior melhoria com rivastigmina adesivos transdérmicos 15 cm2 em comparação com rivastigmina adesivos transdérmicos 10 cm2.
n é o número de pacientes com uma avaliação no início do estudo e a visita correspondente.
A DLSM, IC 95%, e valor de p são baseados em um modelo de ANCOVA ajustado para o país e de base.
* p < 0,05.
Demência2 associada à doença de Parkinson5
A eficácia e segurança da rivastigmina em pacientes portadores de demência2 associada à doença de Parkinson5 têm sido demonstradas com rivastigmina cápsulas, porém não foram conduzidos estudos com rivastigmina adesivos transdérmicos.
Dados farmacocinéticos modelados de um estudo conduzido com os adesivos transdérmicos de rivastigmina, em pacientes com a doença de Alzheimer4, demonstrou que a exposição diária total (AUC10) de rivastigmina adesivos transdérmicos 10 cm² é aproximadamente equivalente à exposição obtida com a cápsula de 6 mg duas vezes ao dia. A dose de rivastigmina cápsulas 6 mg duas vezes ao dia é a maior dose usada em pacientes portadores de demência2 associada à doença de Parkinson5. A dose média diária de manutenção com cápsulas que oferece eficácia superior comparada ao placebo7 em ADAS-Cog e ADCS-CGIC foi de 8,7 mg de rivastigmina. Esta evidência suporta o uso de rivastigmina adesivos transdérmicos em pacientes portadores de demência2 associada à doença de Parkinson5.
Referências Bibliográficas
- [Zechner S, Bernhard G] A 24-week, multicenter, randomized, double-blind, placebo7 and active-controlled, parallel-group evaluation of the efficacy, safety and tolerability of the once-daily Exelon® patch formulation in patients with probable Alzheimer’s disease (MMSE 10-20), Novartis Pharma AG. Basel, Switzerland. 19 Jun 06.
- [Tekin S, Nagel J, Quarg P] Clinical Overview in Alzheimer’s Disease and Dementia associated with Parkinson’s Disease patch. 08 Aug 06.
- Exelon /Prometax (rivastigmine). 2.5 Clinical Overview. Rationale for changes to Core Data Sheet (CDS) / Product Information – Addition of new clinical data from Study D2344 (China), Study D1301 (Japan) and Study DUS44 extension – sections Clinical and ADR. Novartis. 6-May-2014.
- Exelon/Prometax (rivastigmine). 2.5 Clinical Overview. Rationale for changes to Core Data Sheet (CDS) / Exelon Patch 15 in patients with Alzheimer’s dementia. Novartis. 8-Nov-2011.
- Exelon/Prometax (rivastigmine). 2.5 Clinical Overview. Rationale for changes to Core Data Sheet (CDS) / Exelon capsule and patch in dementia associated with Parkinson’s disease. Novartis Pharma AG, 31-Mar-2011.
- [Kuhl DE, Minoshima S, Fessler JÁ et. al. (1996)] In vivo mapping of cholinergic terminals in normal aging, Alzheimer’s disease, and Parkinson’s disease. Ann Neurol;40:399-410.
- [Perry EK, Curtis M, Dick DJ et. al. (1985)] Cholinergic correlates of cognitive impairment in Parkinson's disease: comparisons with Alzheimer's disease. Journal of Neurology, Neurosurgery, and Psychiatry;48:413-421.
CARACTERÍSTICAS FARMACOLÓGICAS
Mecanismo de ação/farmacodinâmica
Classe farmacoterapêutica: inibidor seletivo da colinesterase cerebral. Código ATC: N06DA03.
As alterações patológicas na doença de Alzheimer4 envolvem as vias neuronais colinérgicas11 que se projetam da base do cérebro12 anterior até o córtex cerebral e o hipocampo13. Essas vias estão envolvidas na atenção, no aprendizado, na memória e em outros processos cognitivos14. Acredita-se que a rivastigmina, um inibidor seletivo da acetil e butirilcolinesterase cerebral do tipo carbamato, facilita a neurotransmissão colinérgica15 pela diminuição da degradação da acetilcolina16 liberada por neurônios17 colinérgicos funcionalmente intactos. Dados de estudos com animais indicam que a rivastigmina aumenta seletivamente a disponibilidade de acetilcolina16 no córtex e no hipocampo13. Dessa forma, a rivastigmina pode apresentar um benefício nos déficits cognitivos14 mediados pelo sistema colinérgico18, associados à doença de Alzheimer4 e à doença de Parkinson5. Além disso, existem evidências de que a inibição da colinesterase poderia diminuir a formação de fragmentos19 da proteína amiloidogênica precursora de beta-amiloide (PAP) e, dessa forma, das placas20 amiloides, que são uma das principais características patológicas da doença de Alzheimer4.
A rivastigmina interage com suas enzimas-alvo pela formação de uma ligação covalente que inativa temporariamente as enzimas. Em homens jovens e saudáveis, uma dose oral de 3,0 mg diminui a atividade da acetilcolinesterase (AChE) no líquido cefalorraquidiano21 em aproximadamente 40% dentro da primeira 1,5 hora após a administração. A atividade da enzima22 retorna aos níveis basais cerca de 9 horas após ter sido atingido o efeito inibitório máximo. A atividade da butirilcolinesterase (BuChE) no líquido cefalorraquidiano21 foi transitoriamente inibida e não foi muito diferente do valor basal após 3,6 horas em voluntários jovens e saudáveis. Em pacientes com a doença de Alzheimer4, a inibição da acetilcolinesterase no líquido cefalorraquidiano21 pela rivastigmina se mostrou dose-dependente até 6 mg administrados duas vezes ao dia, a maior dose testada. A inibição da atividade de BuChE no líquido cefalorraquidiano21 de pacientes com a doença de Alzheimer4 pela rivastigmina, foi similar àquela da AChE, com uma mudança, em relação ao valor basal de mais de 60% após a administração de 6 mg duas vezes ao dia. O efeito da rivastigmina na atividade da AChE e BuChE no líquido cefalorraquidiano21 foi mantido após 12 meses de administração, o mais longo período estudado. Foram encontradas correlações estatisticamente significantes entre o grau de inibição pela rivastigmina da AChE e BuChE no líquido cefalorraquidiano21 e alterações em uma medida composta do desempenho cognitivo23 em pacientes com doença de Alzheimer4; entretanto, somente a inibição da BuChE no líquido cefalorraquidiano21 se correlacionou significativa e consistentemente com melhoras nos subtestes relacionados com a velocidade, atenção e memória.
Farmacocinética
Absorção
A absorção de rivastigmina adesivos transdérmicos é lenta. Após a primeira dose, concentrações detectáveis no plasma24 são observadas após um intervalo de tempo de 0,5 – 1 hora. As concentrações, então, aumentam lentamente e tipicamente, após 8 horas, atingem níveis próximos ao máximo, apesar dos valores máximos (Cmáx) serem com frequência atingidos mais tarde (10 – 16 horas). Após o pico, as concentrações no plasma24 diminuem lentamente pelo tempo restante do período de aplicação de 24 horas. Com a dose múltipla (tal como no estado de equilíbrio), após o adesivo anterior ter sido trocado pelo novo, as concentrações plasmáticas no início decrescem lentamente por aproximadamente 40 minutos em média, até a absorção da nova aplicação tornar-se mais rápida que a eliminação, e os níveis plasmáticos começarem a aumentar novamente e alcançar um novo pico em aproximadamente 8 horas. No estado de equilíbrio, níveis de depressão são aproximadamente 50% dos níveis de pico, ao contrário da dose oral, cujas concentrações caem para virtualmente zero entre as doses (vide as Figuras a seguir). Estes tempos das concentrações plasmáticas são observados com todas as concentrações (tamanhos) dos adesivos investigados, desde o adesivo de 5 cm² ao adesivo de 20 cm². Embora menos pronunciada que a formulação oral, a exposição à rivastigmina (Cmáx e AUC10) aumentou proporcionalmente com o aumento de doses do adesivo. O aumento na AUC10 de rivastigmina em relação à menor dose da rivastigmina adesivos transdérmicos de 5 cm² foi de 2,6; 4,9 e 7,8 vezes, para a rivastigmina adesivos transdérmicos de 10 cm², 15 cm² e 20 cm², respectivamente. O índice de flutuação (IF), isto é, uma medida da diferença relativa entre concentrações de pico e de depressão [(Cmáx – Cmín)/Cavg], estava na faixa de 0,57 a 0,77 para o adesivo, demonstrando assim uma flutuação muito menor entre as concentrações de pico e de depressão do que a formulação oral (IF = 3,96 a 6,24). Conforme determinado pela modelagem compartimental, a rivastigmina adesivos transdérmicos de 20 cm² exibiu exposição (AUC24h) em um paciente típico equivalente àquela que seria proporcionada por uma dose oral de cerca de 9 a 10 mg duas vezes ao dia (isto é, 18 a 20 mg/dia), enquanto que a rivastigmina adesivos transdérmicos de 10 cm² exibiu uma exposição equivalente àquela proporcionada por uma dose oral de cerca de 6 mg duas vezes ao dia (isto é, 12 mg/dia).
Figura 1: Concentrações plasmáticas de rivastigmina seguidas de 24 horas de aplicação do adesivo transdérmico
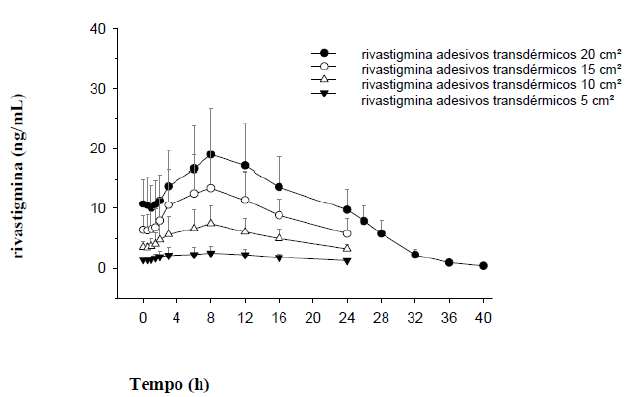
Figura 2: Concentrações plasmáticas de rivastigmina cápsulas, via oral, duas vezes ao dia
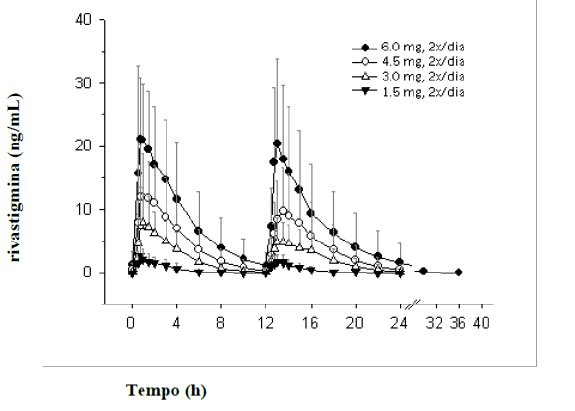
Em um estudo de dose simples que compara diretamente os adesivos com a forma oral, a variabilidade interindivíduos nos parâmetros farmacocinéticos da rivastigmina (ajustada para a dose/kg de peso corpóreo) foi de 43% (Cmáx) e 49% (AUC100-24h) após o adesivo, versus 74% e 103%, respectivamente, após a cápsula oral. Similarmente, a variabilidade interindivíduos nos parâmetros farmacocinéticos de rivastigmina foi menor após o adesivo do que após a cápsula oral no estudo em estado de equilíbrio em pacientes portadores da doença de Alzheimer4 que receberam doses repetidas. A variabilidade interpacientes foi no máximo 45% (Cmáx) e 43% (AUC100-24h) após o adesivo, enquanto que para a forma oral foi de 71% e 73%, respectivamente.
A relação entre a exposição do medicamento no estado de equilíbrio (rivastigmina e metabólito25 NAP226-90) e o peso corporal foi observada nos pacientes com a doença de Alzheimer4. Em comparação aos pacientes com peso corporal de 65 kg, as concentrações da rivastigmina no estado de equilíbrio em pacientes com peso corporal de 35 kg seria aproximadamente o dobro, enquanto que para os pacientes com peso corporal de 100 kg, as concentrações seriam aproximadamente a metade. O efeito do peso corporal na exposição ao medicamento sugere especial atenção durante o aumento na titulação em pacientes com peso corporal muito baixo (veja “Posologia e modo de usar”).
A rivastigmina foi bem liberada do sistema transdérmico durante as 24 horas de aplicação com aproximadamente 50% da dose do medicamento liberada.
A área sob a curva (AUC10∞) da rivastigmina (e metabólito25 NAP226-90) foi maior quando o adesivo foi aplicado na parte superior das costas26, no peito27 ou no braço. Se nenhuma destas partes estiver disponível, pode-se aplicar no abdômen ou coxa28, no entanto, o profissional deve ter em mente que a exposição plasmática de rivastigmina associada a estas partes é aproximadamente 20–30% mais baixa.
Não há acúmulo relevante de rivastigmina ou metabólito25 NAP226-90 no plasma24 em pacientes com a doença de Alzheimer4, exceto no tratamento com adesivo, no qual os níveis plasmáticos no segundo dia foram maiores do que no primeiro.
O perfil farmacocinético dos adesivos transdérmicos de rivastigmina foi comparável em pacientes com doença de Alzheimer4 e em pacientes com demência2 associada à doença de Parkinson5.
Distribuição
A rivastigmina apresenta uma fraca ligação às proteínas29 plasmáticas (aproximadamente 40%). Ela atravessa facilmente a barreira hematoencefálica e apresenta um volume aparente de distribuição na faixa de 1,8 - 2,7 L/kg.
Metabolismo30
A rivastigmina é rápida e extensivamente metabolizada com uma meia-vida de eliminação aparente no plasma24 de aproximadamente 3,4 horas após remoção do sistema transdérmico. A eliminação foi limitada pela absorção (cinética31 flip-flop), que explica o t1/2 mais longo após administração transdérmica (3,4 h) versus oral ou i.v. (1,4 a 1,7 h). O metabolismo30 é principalmente via hidrólise mediada pela colinesterase para o metabólito25 descarbamilado. In vitro, esse metabólito25 apresenta uma inibição mínima da acetilcolinesterase (<10%). Com base em estudos in vitro, não são esperadas interações medicamentosas farmacocinéticas com fármacos metabolizados pelas seguintes isoenzimas do citocromo: CYP1A2, CYP2D6, CYP3A4/5, CYP2E1, CYP2C9, CYP2C8, CYP2C19 ou CYP2B6. Com base em evidência de estudos com animais, as isoenzimas principais do citocromo P450 estão minimamente envolvidas no metabolismo30 da rivastigmina. A depuração plasmática total de rivastigmina foi de aproximadamente 130 litros/h após 0,2 mg de dose intravenosa e diminuiu para 70 litros/h após 2,7 mg de dose intravenosa, a qual é consistente com a farmacocinética não linear e proporcional da rivastigmina causada pela saturação da sua eliminação.
A taxa de AUC10∞ do metabólito25 ao precursor foi em torno de 0,7 após aplicação transdérmica versus 3,5 após administração oral, indicando que muito menos metabolismo30 ocorreu após o tratamento transdérmico. Menos NAP226- 90 é formado após a aplicação do adesivo, presumivelmente por causa da ausência do metabolismo30 pré-sistêmico32 (passagem hepática33 inicial).
Eliminação
A rivastigmina inalterada é encontrada em pequenas quantidades na urina34; a excreção renal35 dos metabólitos36 é a principal via de eliminação. Após a administração de 14C-rivastigmina, a eliminação renal35 foi rápida e essencialmente completa (> 90%) em 24 horas. Menos de 1% da dose administrada é excretada nas fezes.
Populações especiais
Pacientes idosos: A idade não tem impacto na exposição à rivastigmina em pacientes portadores da doença de Alzheimer4 tratados com rivastigmina adesivos transdérmicos.
Pacientes com disfunção hepática33: Nenhum estudo foi conduzido com rivastigmina adesivos transdérmicos em pacientes com disfunção hepática33. Após administração oral, a Cmáx de rivastigmina foi de aproximadamente 60% maior e a AUC10 de rivastigmina foi mais que duas vezes maiores em pacientes com disfunção hepática33 leve à moderada do que em pacientes saudáveis. Após uma única dose oral de 3 mg ou doses múltiplas orais de 6 mg duas vezes ao dia, o clearance (depuração) oral médio da rivastigmina foi de aproximadamente 60-65% mais baixo em pacientes (n = 10, biópsia37 comprovada) com insuficiência hepática38 leve (n = 7, Child-Pugh 5-6) e moderada (n = 3, Child-Pugh 7-9) do que em indivíduos saudáveis (n = 10). Estas alterações farmacocinéticas não tiveram efeito sobre a incidência39 ou gravidade das reações adversas (vide “Posologia e modo de usar” e “Advertências e precauções”).
Pacientes com disfunção renal35: Nenhum estudo foi conduzido com rivastigmina adesivos transdérmicos em pacientes com disfunção renal35. Com base na análise da população, o clearance (depuração) da creatinina40 não apresentou qualquer efeito claro sobre as concentrações da rivastigmina ou de seu metabólito25 no estado de equilíbrio. Não é necessário ajuste da dose em pacientes com insuficiência renal41 (vide “Posologia e modo de usar”).
Dados de segurança pré-clínicos
Toxicidade42 aguda: Os valores de DL50 oral estimados em camundongos foram de 5,6 mg/kg (machos) e de 13,8 mg/kg (fêmeas). Os valores de DL50 oral em ratos foram de 8,1 mg/kg (machos) e de 13,8 mg/kg (fêmeas).
Toxicidade42 de dose múltipla: Estudos de toxicidade42 de dose múltipla oral e tópica em camundongos, ratos, coelhos, cães e porcos mostraram apenas efeitos associados com uma exagerada ação farmacológica. Não foi observada toxicidade42 em órgão-alvo. Dose oral e tópica em estudos com animais foi limitada devido à sensibilidade dos modelos animais utilizados.
Mutagenicidade
A rivastigmina não se apresentou mutagênica em testes de mutação genética43, testes de dano de DNA primário nem em alterações cromossômicas in vivo. Em testes de alterações cromossômicas in vitro, um pequeno aumento no número de células44 portadoras de aberrações cromossômicas ocorreu com concentrações muito elevadas. Entretanto, como não há evidência de atividade clastogênica nos testes in vivo de aberração cromossômica mais relevante, é mais provável que os resultados in vitro tenham configurado observações falso-positivas. Além disso, o principal metabólito25 NAP226-90 não induziu aberrações cromossômicas estruturais em um estudo in vitro, indicando que o composto não tem potencial genotóxico
Carcinogenicidade
Não foi observada evidência de carcinogenicidade em estudos com administração oral e tópica em camundongos e estudo de administração oral em ratos com a dose máxima tolerada. A exposição da rivastigmina e seus metabólitos36 foi aproximadamente equivalente à exposição em humanos com as maiores doses de rivastigmina de cápsulas e adesivos.
Toxicidade42 reprodutiva
Estudos de administração oral em ratas e coelhas prenhas com níveis de dose de até 2,3 mg/kg/dia não demonstraram indicações de potencial teratogênico45 relacionados à rivastigmina. Da mesma forma, não foi demonstrada evidência de efeitos adversos da rivastigmina na fertilidade, função reprodutiva ou crescimento intraútero ou pós-natal em ratos que receberam níveis de dose de até 1,1 mg/kg/dia (vide “Mulheres com potencial para engravidar, gravidez46, lactação47 e fertilidade”). Estudos específicos com sistemas transdérmicos em animais prenhas não foram conduzidos.
Tolerância local
Os adesivos de rivastigmina não foram fototóxicos e considerados como sendo não sensibilizador. Em alguns outros estudos de toxicidade42 dérmica, um leve efeito de irritação na pele48 dos animais de laboratório, incluindo controles, foi observado. Isso pode indicar um potencial da rivastigmina adesivos transdérmicos em induzir leve eritema49 nos pacientes. Uma potencial irritação leve da rivastigmina nos olhos50/mucosa51 foi identificada em um estudo em coelhos (vide “Posologia e modo de usar - Importantes instruções de administração (pacientes e cuidadores devem ser instruídos)”.
CONTRAINDICAÇÕES
O uso de rivastigmina adesivos transdérmicos é contraindicado em pacientes com conhecida hipersensibilidade à rivastigmina, a outros derivados do carbamato ou a qualquer excipiente da fórmula (vide “Composição - Excipientes”).
História prévia de reações no local de aplicação de dermatite52 alérgica de contato com rivastigmina através do sistema transdérmico (vide “Advertências e precauções).
ADVERTÊNCIAS E PRECAUÇÕES
Uso incorreto do medicamento e erros de dosagem resultando em superdose
O uso incorreto do medicamento e erros de dosagem com rivastigmina adesivos transdérmicos resultaram em reações adversas graves. Em alguns casos foi necessária a hospitalização, e raramente conduziram à morte (vide “Superdose”). A maioria dos casos de uso incorreto do medicamento e erros de dosagem envolveu a não remoção do adesivo antigo, quando colocado um novo e o uso de múltiplos adesivos de uma vez. Os pacientes e seus cuidadores devem ser orientados sobre as importantes instruções de administração para rivastigmina adesivos transdérmicos (vide “Posologia e modo de usar”).
Doenças gastrintestinais
A incidência39 e gravidade das reações adversas geralmente aumentam com o aumento de doses, particularmente na troca de dose. Se o tratamento for interrompido por três dias, o tratamento deve ser reiniciado com rivastigmina adesivos transdérmicos 5 cm².
Transtornos gastrintestinais tais como náusea53, vômito54 e diarreia55 podem ocorrer no início do tratamento e/ou no aumento de dose. Eles podem ser amenizados com a redução da dose. Em alguns casos, o uso de rivastigmina adesivos transdérmicos foi descontinuado. Pacientes que apresentam sinais56 ou sintomas57 de desidratação58 resultante de vômitos59 ou diarreia55 prolongada podem ser controlados com hidratação i.v. e redução da dose ou descontinuação, se reconhecidos e tratados prontamente. A desidratação58 pode estar associada a resultados graves (vide “Reações adversas”).
Perda de peso
Pacientes portadores da doença de Alzheimer4 podem perder peso durante o tratamento com inibidores da colinesterase, incluindo a rivastigmina. O peso dos pacientes deve ser monitorado durante a terapia com rivastigmina adesivos transdérmicos.
Outras reações adversas do aumento da atividade colinérgica15
Assim como outras substâncias colinérgicas11, deve-se ter cuidado ao utilizar rivastigmina adesivos transdérmicos:
- Em pacientes com doença do nódulo sinusal60 ou defeitos na condução (bloqueio sinoatrial, bloqueio atrioventricular) (vide “Reações adversas”);
- Em pacientes com úlceras61 gástrica ou duodenal ativas ou pacientes pré-dispostos a estas condições, pois a secreção ácido- gástrica pode ser aumentada;
- Em pacientes pré-dispostos a obstrução urinária e convulsões, pois os agentes colinomiméticos podem induzir ou exacerbar estas patologias;
- Em pacientes com história de asma62 ou doença pulmonar obstrutiva.
Como com outros colinomiméticos, a rivastigmina pode induzir ou exacerbar sintomas57 extrapiramidais. Em pacientes com demência2 associada à doença de Parkinson5 que estavam sendo tratados com rivastigmina cápsulas, foi observada piora dos sintomas57 parkinsonianos, particularmente o tremor. Tais reações adversas podem também ocorrer com rivastigmina adesivos transdérmicos, particularmente com rivastigmina adesivos transdérmicos 15 cm² e rivastigmina adesivos transdérmicos 20 cm² que proporcionam maior exposição (AUC10) que aquela atingida pela administração de rivastigmina cápsulas de 6 mg, duas vezes ao dia.
Reações no local de aplicação e reações cutâneas63
Reações cutâneas63 no local da aplicação podem ocorrer com rivastigmina adesivos transdérmicos e são geralmente de intensidade leve ou moderada (vide “Reações adversas”). Estas reações não são em si uma indicação de sensibilização. Entretanto, o uso de rivastigmina patch pode levar a dermatite52 de contato alérgica.
Deve-se suspeitar de dermatite52 de contato alérgica se as reações no local de aplicação se espalharam além do tamanho do adesivo, se houver evidência de uma reação mais intensa no local (por exemplo, eritema49 aumentando, edema64, pápulas65, vesículas66) e se os sintomas57 não melhoram significativamente dentro de 48 horas após a remoção do patch. Nestes casos, o tratamento deve ser descontinuado (vide “Contraindicações”).
Em pacientes que desenvolvem reações no local de aplicação sugestivas de dermatite52 de contato alérgica a rivastigmina adesivos transdérmicos e que continuam precisando de rivastigmina, o tratamento deve ser transferido para a rivastigmina oral somente após testes de alergia67 negativa e sob rigorosa supervisão médica. É possível que alguns pacientes sensibilizados à rivastigmina por exposição ao adesivo não consigam utilizar a rivastigmina em qualquer forma.
Houve relatos de pós-comercialização isolados de pacientes com dermatites alérgicas (disseminada) quando a rivastigmina foi administrada, independentemente da via de administração (oral, transdérmica). Nestes casos, o tratamento deve ser descontinuado (vide “Contraindicações”). Pacientes e cuidadores devem ser instruídos.
Populações especiais
- Pacientes com peso corporal abaixo de 50 kg podem apresentar mais reações adversas e podem ser mais propícios a descontinuar o tratamento por causa destas reações adversas. Cuidadosamente titular e monitorar estes pacientes para as reações adversas (por exemplo, náusea53 ou vômito54 excessivo) e considerar a redução da dose se as reações adversas ocorrerem (vide “Posologia e modo de usar”);
- Disfunção hepática33: pacientes com disfunção hepática33 clinicamente significativa podem apresentar mais reações adversas. Deve-se seguir rigorosamente as recomendações de posologia na titulação, de acordo com a tolerabilidade individual. Pacientes com insuficiência hepática38 grave não foram estudados. Deve-se ter cuidado especial na titulação destes pacientes (vide “Posologia e modo de usar” e “Características farmacológicas – Farmacocinética”).
Mulheres com potencial para engravidar, gravidez46, lactação47 e fertilidade
Mulheres com potencial para engravidar
Não há informações disponíveis sobre os efeitos da rivastigmina em mulheres em idade fértil.
Gravidez46
Em animais prenhas, a rivastigmina e/ou seus metabólitos36 atravessaram a placenta. Não se sabe se isto ocorre em seres humanos. Em estudos com animais, a rivastigmina não se mostrou teratogênica68. Entretanto, a segurança de rivastigmina na gravidez46 humana não foi estabelecida e o mesmo deve ser utilizado em mulheres grávidas apenas se o benefício potencial for superior ao possível risco ao feto69.
Este medicamento pertence à categoria B de risco na gravidez46.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Fertilidade
Em ratos machos e fêmeas, não foram observadas reações adversas da rivastigmina na fertilidade ou desempenho reprodutivo na geração dos pais ou nos filhos (vide “Dados de segurança pré-clínicos”). Não há informações disponíveis sobre os efeitos da rivastigmina na fertilidade humana.
Lactação47
Em animais, a rivastigmina e/ou seus metabólitos36 foram excretados no leite materno. Não se sabe se rivastigmina é excretada no leite materno humano e, portanto, pacientes que utilizam rivastigmina não devem amamentar.
Efeitos na habilidade de dirigir e operar máquinas
A demência2 associada à doença de Alzheimer4 e de Parkinson pode causar comprometimento gradual sobre a habilidade de dirigir veículos ou operar máquinas. A rivastigmina pode induzir tontura70 e sonolência, principalmente no início do tratamento ou no aumento de dose. Portanto, em pacientes com demência2 tratados com rivastigmina, a habilidade de continuar a dirigir veículos e/ou operar máquinas complexas deve ser rotineiramente avaliada pelo médico.
INTERAÇÕES MEDICAMENTOSAS
Estudos específicos com rivastigmina adesivos transdérmicos não foram realizados.
A rivastigmina é metabolizada principalmente pela hidrólise por esterases. Um metabolismo30 mínimo ocorre através da maioria das isoenzimas do citocromo P450. Dessa forma, não são previstas interações farmacocinéticas com outros fármacos metabolizados por essas enzimas.
Interações antecipadas, resultando em uso concomitante não recomendado
metoclopramida
Considerando a possibilidade de um efeito extrapiramidal aditivo não é recomendado o uso concomitante de metoclopramida e rivastigmina.
Medicamentos que agem no sistema colinérgico18
Tendo em vista seus efeitos farmacodinâmicos, a rivastigmina não deve ser administrada concomitantemente com outros medicamentos colinomiméticos devido ao possível efeito aditivo. A rivastigmina também pode interferir com a atividade de medicamentos anticolinérgicos (por exemplo, a oxibutinina, tolterodina).
Relaxantes musculares do tipo succinilcolina
Como um inibidor de colinesterase, a rivastigmina pode potencializar os efeitos relaxantes musculares do tipo succinilcolina durante a anestesia71.
Interações observadas a serem consideradas
- Betabloqueadores
Efeitos aditivos que levam à bradicardia72 (que pode resultar em síncope73) foram relatados com o uso combinado de vários betabloqueadores (incluindo atenolol) e rivastigmina. Espera-se que os betabloqueadores cardioseletivos sejam associados ao maior risco, mas relatos também foram recebidos em pacientes com outros betabloqueadores.
Interação com a nicotina
A análise farmacocinética da população mostrou que o uso de nicotina aumenta o clearance (depuração) oral da rivastigmina em 23% em pacientes com demência2 de Alzheimer3 (n = 75 fumantes e 549 não fumantes), após doses orais de até 12 mg/dia de cápsulas de rivastigmina.
Interações com medicamentos geralmente usados concomitantemente
Não foram observadas interações farmacocinéticas entre a rivastigmina e digoxina, varfarina, diazepam ou fluoxetina em estudos com voluntários sadios. O aumento no tempo de protrombina74 induzido pela varfarina não é afetado pela administração de rivastigmina. Não foram observados efeitos desfavoráveis na condução cardíaca após a administração concomitante de digoxina e rivastigmina.
A administração concomitante de rivastigmina com medicamentos prescritos comumente, tais como antiácidos75, antieméticos76, antidiabéticos, anti-hipertensivos de ação central, bloqueadores de canal de cálcio, drogas inotrópicas, antianginosos, anti- inflamatórios não esteroidais, estrógenos, analgésicos77, benzodiazepínicos e anti-histamínicos, não foi associada às alterações na cinética31 de rivastigmina nem ao aumento do risco de efeitos desfavoráveis clinicamente relevantes.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Conservar em temperatura ambiente (entre 15 e 30°C). Proteger da luz e umidade.
É necessário manter o produto protegido da luz a partir da retirada da embalagem original, durante todo o período de utilização. A região do corpo na qual o produto estiver aplicado não deve ser exposta à luz.
Desde que respeitados os cuidados de armazenamento, o medicamento apresenta uma validade de 24 meses a contar da data de sua fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original. Antes de usar, observe o aspecto do medicamento.
Características físicas e organolépticas do produto
Vivencia Patch 9 mg (4,6 mg/24h): adesivo de dupla camada, película de suporte em forma de círculo, branco e translúcido com 5 cm² de área e filme de forro retangular com gravação em relevo.
Vivencia Patch 18 mg (9,5 mg/24h): adesivo de dupla camada, película de suporte em forma de círculo, branco e translúcido com 10 cm² de área e filme de forro retangular com gravação em relevo.
Vivencia Patch 27 mg (13,3 mg/24h): adesivo de dupla camada, película de suporte em forma de círculo, branco e translúcido com 15 cm² de área e filme de forro retangular com gravação em relevo.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Método de administração
Os adesivos transdérmicos devem ser aplicados uma vez ao dia sobre a pele48 limpa, seca, sem pelos, intacta, nas partes superior ou inferior das costas26, no braço ou peito27, em lugares que não sofrerão atritos com roupas apertadas. O adesivo deve ser substituído por um novo após 24 horas.
Importantes instruções de administração (pacientes e cuidadores devem ser instruídos)
- O adesivo do dia anterior deve ser removido antes de se aplicar um novo;
- O adesivo deve ser substituído por um novo após 24 horas. Somente um adesivo deve ser usado de cada vez (vide “Advertências e precauções” e “Superdose”);
- O adesivo não deve ser aplicado em locais da pele48 que estejam vermelhos, irritados ou cortados. Recomenda-se alterar o local de aplicação diariamente para evitar uma potencial irritação cutânea78, embora adesivos consecutivos possam ser aplicados no mesmo local anatômico (por exemplo, em outro ponto na parte superior das costas26). Não utilize um novo adesivo exatamente no mesmo local da pele48 no prazo de 14 dias, a fim de minimizar o potencial de irritação cutânea78;
- O adesivo deve ser pressionado firmemente por pelo menos 30 segundos usando a palma da mão79 até que esteja bem colado;
- Se o adesivo cair, um novo deve ser aplicado durante o resto do dia, então ele deve ser substituído no horário habitual do dia seguinte;
- O adesivo pode ser usado em situações do dia a dia, inclusive no banho e nos dias de calor;
- O adesivo não deve ser exposto a qualquer fonte de calor externo (por exemplo luz solar excessiva, saunas) por longos períodos de tempo;
- O adesivo não deve ser cortado em pedaços;
- Após a remoção do adesivo de rivastigmina, este deve ser dobrado na metade com a parte aderente para dentro e deve ser pressionado. O adesivo usado deve ser retornado ao sachê original e descartado de forma segura, fora do alcance das crianças. Devem ser lavadas as mãos80 com água e sabão após a remoção do adesivo. Em caso de contato com os olhos50 ou se os olhos50 se tornarem vermelhos depois de manusear o adesivo, estes devem ser lavados imediata e abundantemente com água abundante e deve ser procurado um médico se os sintomas57 não forem resolvidos.
Posologia
|
Adesivos |
Dose de rivastigmina base |
Taxa de liberação in vivo em 24 h de rivastigmina base |
|
Vivencia Patch 5 cm² |
9 mg |
4,6 mg |
|
Vivencia Patch 10 cm² |
18 mg |
9,5 mg |
|
Vivencia Patch 15 cm² |
27 mg |
13,3 mg |
Dose inicial
O tratamento é iniciado com rivastigmina adesivos transdérmicos 5 cm², uma vez ao dia.
Após no mínimo quatro semanas de tratamento, se bem tolerado, esta dose deve ser aumentada para rivastigmina adesivos transdérmicos 10 cm², que é a dose efetiva recomendada.
Dose de manutenção
Rivastigmina adesivos transdérmicos 10 cm² é recomendado como dose diária de manutenção, a qual pode ser continuada enquanto os efeitos benéficos estiverem presentes.
Respostas individuais à rivastigmina podem variar e alguns pacientes podem ter efeitos benéficos adicionais com doses mais altas. Aumentos subsequentes para rivastigmina adesivos transdérmicos 15 cm² devem ser sempre baseados na boa tolerabilidade da dose atual, e devem ser considerados somente após um mínimo de quatro semanas de tratamento com cada nível de dose.
Interrupção do tratamento
- O tratamento deve ser temporariamente interrompido, se reações adversas gastrintestinais e/ou piora dos sintomas57 extrapiramidais existentes (por ex.: tremor) forem observadas, até que estas reações sejam solucionadas. O tratamento com adesivo pode ser reiniciado com a mesma dose, se este não estiver sido interrompido por mais do que três dias. Caso contrário, o tratamento deve ser reiniciado com rivastigmina adesivos transdérmicos 5 cm²;
- Se os efeitos adversos persistirem na retomada da terapia, a dose deve ser temporariamente reduzida para a anterior melhor tolerada pelo paciente.
Transferência de pacientes em tratamento com cápsulas ou solução oral para o tratamento com adesivos
Pacientes tratados com rivastigmina cápsulas ou solução oral podem ser transferidos para rivastigmina adesivos transdérmicos, conforme segue:
- Um paciente que está recebendo uma dose < 6 mg/dia de rivastigmina via oral, pode ser transferido para rivastigmina adesivos transdérmicos 5 cm²;
- Um paciente que está recebendo uma dose de 6 a 12 mg/dia de rivastigmina via oral, pode ser diretamente transferido para rivastigmina adesivos transdérmicos 10 cm².
É recomendado que a aplicação do primeiro adesivo seja feita um dia após a última dose oral.
População especial:
Pacientes pesando menos de 50 kg: Deve-se ter cautela na titulação destes pacientes uma vez que eles podem apresentar mais reações adversas. Cuidadosamente titular e monitorar esses pacientes para as reações adversas (por exemplo, náusea53 ou vômito54 excessivo) e considerar a redução da dose se as reações adversas ocorrerem (vide “Advertências e precauções”).
Insuficiência hepática38: Devido ao aumento da exposição na insuficiência hepática38 leve a moderada, como observado com a formulação oral, devem ser seguidas rigorosamente as recomendações de posologia na titulação, de acordo com a tolerabilidade individual. Pacientes com insuficiência hepática38 clinicamente significativa podem apresentar mais reações adversas dose-dependentes. Pacientes com insuficiência hepática38 grave não foram estudados. Cuidado especial deve ser tomado na titulação destes pacientes (vide “Advertências e precauções” e “Características farmacológicas – Farmacocinética”).
Pacientes idosos: A idade não tem impacto na exposição da rivastigmina em pacientes portadores da doença de Alzheimer4 tratados com rivastigmina adesivos transdérmicos.
Insuficiência renal41: Não é necessário ajuste de dose em pacientes com disfunção renal35 (vide “Características farmacológicas – Farmacocinética”).
Pacientes pediátricos: Crianças e adolescentes (abaixo de 18 anos): o uso de rivastigmina não é recomendado em crianças.
Este medicamento não deve ser cortado.
REAÇÕES ADVERSAS
As incidências em geral das reações adversas em pacientes tratados com rivastigmina adesivos transdérmicos 10 cm² foram mais baixas do que em pacientes que receberam tratamento com rivastigmina cápsulas. Náusea53 e vômito54 foram os eventos adversos mais comuns em pacientes que receberam tratamento ativo, e ocorreram em taxas similares tanto no grupo de rivastigmina adesivos transdérmicos 20 cm² quanto no grupo de cápsulas. Entretanto, as porcentagens destes dois eventos foram substancialmente mais baixas com o grupo de rivastigmina adesivos transdérmicos 10 cm².
As reações adversas relatadas mais comumente são gastrintestinais incluindo náuseas81 e vômitos59, especialmente durante a titulação. As reações adversas nas Tabelas 4 e 5 estão classificadas segundo seus títulos de frequência, da mais para a menos frequente, utilizando o seguinte critério: Muito comum (≥ 1/10); comum (≥ 1/100, < 1/10); incomum (≥ 1/1.000, < 1/100); raras (≥ 1/10.000, < 1/1.000); muito raro (< 1/10.000), incluindo relatos isolados.
Tabela 4: Reações adversas relatadas em 2.687 pacientes portadores da doença de Alzheimer4 tratados em estudos clínicos de 24 semanas a 48 semanas, randomizado82 controlado, com rivastigmina adesivos transdérmicos de todas as doses (rivastigmina adesivos transdérmicos 5 cm² à rivastigmina adesivos transdérmicos 20 cm²).
|
Distúrbios do metabolismo30 e nutricionais |
|
|
Comum |
Anorexia83 e diminuição do apetite. |
|
Incomum |
Desidratação58. |
|
Distúrbios psiquiátricos |
|
|
Comum |
Ansiedade, depressão e insônia. |
|
Incomum |
Agitação, delírio84, alucinações85 e agressividade. |
|
Distúrbios do sistema nervoso86 |
|
|
Comum |
Tontura70 e dor de cabeça87 |
| Incomum | Acidente cerebrovascular, síncope73, sonolência* e hiperatividade psicomotora88. |
|
Distúrbios cardíacos |
|
|
Incomum |
Arritmia89 cardíaca (por ex.: bradicardia72 e extrassístole supraventricular). |
|
Distúrbios gastrintestinais |
|
|
Muito comum |
Náusea53. |
|
Comum |
Vômito54, diarreia55, dispepsia90 e dor abdominal. |
|
Incomum |
Úlcera gástrica91, hemorragia92 gastrintestinal (por ex.: duodenite hemorrágica93) |
|
Muito rara |
Hemorragia92 gastrintestinal, pancreatite94 leve e vômito54 grave associado à ruptura esofágica. |
|
Distúrbios renais e urinários |
|
| Comum | Incontinência urinária95 |
|
Distúrbios da pele48 e tecidos subcutâneos |
|
|
Incomum |
Hiperidrose96 |
|
Distúrbios gerais e condições no local de administração |
|
|
Comum |
Reações no local de aplicação, eritema49 no local de administração**, prurido97 no local de administração**, edema64 no local de administração**, fadiga98 e astenia99. |
|
Incomum |
Dermatite52 de contato ** e mal-estar. |
|
Rara |
Queda |
|
Laboratoriais |
|
| Comum | Perda de peso |
|
Infecções100 e infestações |
|
| Comum | Infecção101 do trato urinário102 |
* Em um estudo controlado de 24 semanas em pacientes chineses, sonolência foi relatado como "comum".
** Em um estudo controlado de 24 semanas em pacientes japoneses, eritema49 no local de administração, prurido97 no local da administração, edema64 no local da administração e dermatite52 de contato foram reportados como "muito comum".
Tabela 5: Reações adversas relatadas em estudo clínico aberto de 24 semanas conduzido com rivastigmina adesivos transdérmicos em pacientes com demência2 associada com a doença de Parkinson5.
|
Reações adversas |
|
Rivastigmina adesivos transdérmicos n (%) |
|
Total de pacientes estudados |
|
288 (100) |
|
Distúrbios psiquiátricos |
||
|
Comum |
Insônia |
18 (6,3) |
|
Comum |
Depressão |
16 (5,6) |
|
Comum |
Ansiedade |
15 (5,2) |
|
Comum |
Agitação |
8 (2,8) |
|
Distúrbios do sistema nervoso86 |
||
|
Comum |
Tremor |
21 (7,3) |
|
Comum |
Tontura70 |
16 (5,6) |
|
Comum |
Sonolência |
12 (4,2) |
|
Comum |
Hipocinesia |
11 (3,8) |
|
Comum |
Bradicinesia103 |
10 (3,5) |
|
Comum |
Rigidez em roda dentada |
8 (2,8) |
|
Comum |
Discinesia |
7 (2,4) |
|
Distúrbios gastrintestinais |
||
|
Comum |
Dor abdominal |
6 (2,1) |
|
Distúrbios vasculares104 |
||
|
Comum |
Hipertensão105 |
9 (3,1) |
|
Distúrbios gerais e condições no local da administração |
||
|
Muito comum |
Quedas |
34 (11,8) |
|
Muito comum |
Eritema49 no local da administração |
31 (10,8) |
|
Comum |
Irritação no local da administração, prurido97, erupção106 cutânea78 (rash107) |
9 (3,1); 13 (4,5); 7 (2,4) |
|
Comum |
Fadiga98 |
10 (3,5) |
|
Comum |
Astenia99 |
6 (2,1) |
|
Comum |
Distúrbio no modo de andar |
11 (3,8) |
Reações adversas adicionais observadas durante um estudo aberto prospectivo108 de 76 semanas, em pacientes com demência2 associada a doença de Parkinson5 tratados com rivastigmina adesivo transdérmico: desidratação58, perda de peso, agressividade, alucinação109 visual (comum).
Em pacientes com demência2 associada a doença de Parkinson5, as seguintes reações adversas foram observadas somente nos estudos clínicos conduzidos com rivastigmina cápsulas: náusea53, vômito54 (muito comum); diminuição de apetite, agitação, agravamento da doença de Parkinson5, bradicardia72, diarreia55, dispepsia90, hipersecreção salivar, aumento de sudorese110 (comum); distonia111, fibrilação atrial, bloqueio atrioventricular (incomum).
Reações adversas ao medicamento de relatos espontâneos pós-comercialização
As seguintes reações adversas adicionais foram identificadas com base em relatos espontâneos pós-comercialização. Como estas reações são relatadas voluntariamente a partir de uma população de tamanho não definido, nem sempre é possível estimar confiavelmente sua frequência.
Relatados raramente: hipertensão105, hipersensibilidade no local da aplicação, prurido97, erupção106 cutânea78 (rash107), eritema49, urticária112, formação de bolhas e dermatite52 alérgica.
Relatados muito raramente: taquicardia113, bloqueio atrioventricular, fibrilação atrial, pancreatite94, convulsão114. Observou-se agravamento de sintomas57 da doença de Parkinson5 em pacientes que utilizaram rivastigmina adesivos transdérmicos
Frequência desconhecida: hepatite115, agitação, síndrome116 do nódulo sinusal60, exames anormais da função do fígado117, dermatite52 alérgica (disseminada), sintomas57 extrapiramidais em pacientes com demência2 de Alzheimer3, tremor, pesadelos.
Reações adversas adicionais ao medicamento que foram relatadas com o uso de rivastigmina cápsulas/solução oral
Muito raras: vômito54 grave associado com ruptura esofágica.
Raras: angina118 pectoris, infarto do miocárdio119 e úlceras61 duodenais.
Comuns: confusão.
Informação obtida em estudos clínicos em pacientes com demência2 de Alzheimer3 tratados com rivastigmina adesivos transdérmicos.
As seguintes reações adversas foram relatadas em pacientes com demência2 associada à doença de Alzheimer4 tratados com rivastigmina adesivos transdérmicos.
Tabela 6: Reações adversas (≥ 2% em todos os grupos de rivastigmina adesivos transdérmicos) do estudo clínico, duplo-cego, placebo7 controlado de 24 semanas conduzidos com rivastigmina adesivos transdérmicos em pacientes com demência2 por doença de Alzheimer4 leve a moderada.
|
|
Grupo rivastigmina adesivos transdérmicos 10 cm² |
Grupo rivastigmina adesivos transdérmicos 20 cm² |
Rivastigmina cápsulas 12mg/dia |
Placebo7 |
Todos os grupos de rivastigmina adesivos transdérmicos |
|
|
n (%) |
n (%) |
n (%) |
n (%) |
n (%) |
|
Total de pacientes estudados |
291 |
303 |
294 |
302 |
594 |
|
Total de pacientes com reações adversas |
147 (50,5) |
200 (66,0) |
186 (63,3) |
139 (46,0) |
347 (58,4) |
|
Náusea53 |
21 (7,2) |
64 (21,1) |
68 (23,1) |
15 (5,0) |
85 (14,3) |
|
Vômito54 |
18 (6,2) |
57 (18,8) |
50 (17,0) |
10 (3,3) |
75 (12,6) |
|
Diarreia55 |
18 (6,2) |
31 (10,2) |
16 (5,4) |
10 (3,3) |
49 (8,2) |
|
Perda de peso |
8 (2,7) |
23 (7,6) |
16 (5,4) |
4 (1,3) |
31 (5,2) |
|
Tontura70 |
7 (2,4) |
21 (6,9) |
22 (7,5) |
7 (2,3) |
28 (4,7) |
|
Diminuição do apetite |
2 (0,7) |
15 (5,0) |
12 (4,1) |
3 (1,0) |
17 (2,9) |
|
Dor de cabeça87 |
10 (3,4) |
13 (4,3) |
18 (6,1) |
5 (1,7) |
23 (3,9) |
|
Anorexia83 |
7 (2,4) |
12 (4,0) |
14 (4,8) |
3 (1,0) |
19 (3,2) |
|
Depressão |
11 (3,8) |
12 (4,0) |
13 (4,4) |
4 (1,3) |
23 (3,9) |
|
Insônia |
4 (1,4) |
12 (4,0) |
6 (2,0) |
6 (2,0) |
16 (2,7) |
|
Dor abdominal |
7 (2,4) |
11 (3,6) |
4 (1,4) |
2 (0,7) |
18 (3,0) |
|
Astenia99 |
5 (1,7) |
9 (3,0) |
17 (5,8) |
3 (1,0) |
14 (2,4) |
|
Ansiedade |
9 (3,1) |
8 (2,6) |
5 (1,7) |
4 (1,3) |
17 (2,9) |
|
Fadiga98 |
5 (1,7) |
7 (2,3) |
2 (0,7) |
4 (1,3) |
12 (2,0) |
Reações no local de aplicação (irritação da pele48)
Em estudos clínicos controlados, duplo-cego, as reações no local de aplicação foram geralmente leves a moderadas em gravidade. A incidência39 de reações cutâneas63 no local de aplicação que levaram à interrupção foi observada em ≤ 2,3% dos pacientes que utilizaram rivastigmina adesivos transdérmicos. Esse número foi de 4,9% e de 8,4% na população chinesa e na população japonesa, respectivamente.
Casos de irritação da pele48 foram identificados separadamente por um investigador neutro, utilizando uma escala de irritação da pele48. Quando observada, foi de gravidade muito leve ou leve e foi classificada como grave em ≤ 2,2% dos pacientes tratados com rivastigmina adesivos transdérmicos,em um estudo controlado, duplo-cego e em ≤ 3,7% dos pacientes tratados com rivastigmina adesivos transdérmicos em um estudo controlado duplo-cego em pacientes japoneses.
Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Sintomas57: a maioria dos casos de superdose acidental não tem sido associada a nenhum sinal120 ou sintoma121 clínico e quase todos os pacientes envolvidos continuaram o tratamento com rivastigmina. Nos casos em que ocorreram sintomas57, estes incluíram náuseas81, vômitos59, diarreia55, dor abdominal, tontura70, tremor, dor de cabeça87, sonolência, bradicardia72, estado de confusão, hiperidrose96, hipertensão105, alucinações85 e mal-estar. A superdose com inibidores da colinesterase pode resultar em crise colinérgica15 caracterizada por náusea53 severa, vômito54, salivação, sudorese110, bradicardia72, hipotensão122, depressão respiratória e convulsões. A fraqueza muscular é uma possibilidade e pode resultar em morte se os músculos respiratórios123 estiverem envolvidos. Devido ao conhecido efeito vagotônico dos inibidores de colinesterase sobre o coração124, bradicardia72 e/ou síncope73 podem também ocorrer.
Superdose com rivastigmina adesivos transdérmicos resultante de mau uso ou erro na medicação (aplicação de múltiplos adesivos ao mesmo tempo) foi relatado na pós-comercialização e raramente em estudos clínicos. Desfecho fatal foi raramente relatado com superdose de rivastigmina e a relação com a rivastigmina não ficou clara. Os sintomas57 de superdose e os resultados variam de paciente para paciente125, e a gravidade do resultado não é previsivelmente relacionada com a quantidade da superdose.
Tratamento: uma vez que a rivastigmina apresenta meia-vida plasmática de cerca de 3,4 horas e duração da inibição da acetilcolinesterase de cerca de 9 horas, é recomendado que, em casos de superdose assintomática, todos os adesivos de rivastigmina adesivos transdérmicos sejam removidos imediatamente e nenhum adesivo deve ser utilizado pelas próximas 24 horas. Nos casos de superdose acompanhada por vômito54 e náusea53 grave, o uso de antieméticos76 deve ser considerado. Tratamento sintomático126 para outros eventos adversos deve ser realizado, se necessário.
Na superdose grave, a atropina pode ser utilizada. Recomenda-se uma dose inicial de 0,03 mg/kg i.v. de sulfato de atropina, com doses subsequentes baseadas na resposta clínica. Não é recomendado o uso da escopolamina como antídoto127.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
SÓ PODE SER VENDIDO COM RETENÇÃO DA RECEITA
MS - 1.0573.0780
Farmacêutica Responsável: Gabriela Mallmann - CRF-SP n° 30.138
Importado por:
Aché Laboratórios Farmacêuticos S.A.
Av. Brigadeiro Faria Lima, 201 - 20º andar São Paulo – SP
CNPJ 60.659.463/0029-92
Fabricado por:
SK Chemicals Co., Ltd.
Cheongju – Coreia do Sul
SAC 0800 701 6900