Atentah (Bula do profissional de saúde)
APSEN FARMACEUTICA S/A
IDENTIFICAÇÃO DO MEDICAMENTO
Atentah
Cápsulas 10 mg,18 mg, 25 mg, 40 mg, 60 mg e 80 mg
Caixas com 30 cápsulas
USO ORAL
USO ADULTO E PEDIÁTRICO ACIMA DE 6 ANOS
COMPOSIÇÃO:
Cada cápsula de Atentah 10 mg contém:
| Cloridrato de atomoxetina (equivalente a 10 mg de atomoxetina) | 11,428 mg |
| excipiente q.s.p. | 1 cápsula |
Excipientes: amido, estearato de magnésio, gelatina e dióxido de titânio.
Cada cápsula de 18 mg contém:
| Cloridrato de atomoxetina (equivalente a 18 mg de atomoxetina) | 20,570 mg |
| excipiente q.s.p. | 1 cápsula |
Excipientes: amido, estearato de magnésio, gelatina, amarelo de quinolina, amarelo crepúsculo e dióxido de titânio.
Cada cápsula de 25 mg contém:
| Cloridrato de atomoxetina (equivalente a 25 mg de atomoxetina) | 28,569 mg |
| excipiente q.s.p. | 1 cápsula |
Excipientes: amido, estearato de magnésio, gelatina, azul brilhante, vermelho allura 129 e dióxido de titânio.
Cada cápsula de 40 mg contém:
| Cloridrato de atomoxetina (equivalente a 40 mg de atomoxetina) | 45,711 mg |
| excipiente q.s.p. | 1 cápsula |
Excipientes: amido, estearato de magnésio, gelatina, azul brilhante, vermelho allura 129 e dióxido de titânio.
Cada cápsula de 60 mg contém:
| Cloridrato de atomoxetina (equivalente a 60 mg de atomoxetina) | 68,567 mg |
| excipiente q.s.p. | 1 cápsula |
Excipientes: amido, estearato de magnésio, gelatina, azul brilhante, vermelho allura 129, amarelo de quinolina, amarelo crepúsculo e dióxido de titânio.
Cada cápsula de 80 mg contém:
| Cloridrato de atomoxetina (equivalente a 80 mg de atomoxetina) | 91,422 mg |
| excipiente q.s.p. | 1 cápsula |
Excipientes: amido, estearato de magnésio, gelatina, azul brilhante, vermelho allura 129, amarelo de quinolina e dióxido de titânio.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE1
INDICAÇÕES
Atentah é indicado para o tratamento do Transtorno de Déficit de Atenção/Hiperatividade (TDAH) em pacientes adultos, adolescentes ou pediátricos com idade superior a 6 anos.
RESULTADOS DE EFICÁCIA
A eficácia de atomoxetina no tratamento do TDAH foi estabelecida em sete estudos clínicos randomizados, duplo-cegos e placebo2-controlados, realizados em crianças, adolescentes e adultos, que preencheram os critérios da 4ª edição do Manual Estatístico e de Diagnóstico3 (DSM-IV) para o TDAH.
Estudos de TDAH em Crianças e Adolescentes
A eficácia de atomoxetina no tratamento do TDAH foi estabelecida em 4 estudos randomizados, duplo- cegos e controlados por placebo2 de pacientes pediátricos (idades de 6 a 18 anos). Aproximadamente um terço dos pacientes preencheram os critérios do DSM-IV para subtipo desatento e dois terços preencheram os critérios para os subtipos desatento e hiperativo / impulsivo.
Os sinais4 e sintomas5 de TDAH foram avaliados por uma comparação da mudança média da linha de base até o desfecho de pacientes tratados com atomoxetina e placebo2, adotando uma análise por “intenção de tratar” para a Escala para TDAH versão IV para pais (ADHDRS), administrada e pontuada pelo investigador, incluindo a pontuação total da escala e as subescalas: hiperativo/impulsivo e desatento. Cada item na Escala de Avaliação do TDAH avalia um sintoma6, de acordo com os critérios para TDAH no DSM-IV.
No Estudo 1, um estudo do tratamento agudo7 de 8 semanas, randomizado8, duplo-cego, controlado por placebo2, dose-resposta em crianças e adolescentes de 8 a 18 anos (N = 297), os pacientes receberam uma dose fixa de atomoxetina (0,5, 1,2 ou 1,8 mg / kg / dia) ou placebo2. A atomoxetina foi administrada como uma dose dividida no início da manhã e no final da tarde / início da noite. Nas 2 doses mais altas, a melhora dos sintomas5 do TDAH se mostrou estatisticamente superior nos pacientes tratados com atomoxetina, comparado aos pacientes tratados com placebo2, conforme medido na escala de ADHDRS. A dose de atomoxetina de 1,8 mg / kg / dia não proporcionou nenhum benefício adicional em relação ao observado com a dose de 1,2 mg / kg / dia. A dose de atomoxetina de 0,5 mg / kg / dia não foi superior ao placebo2.
No Estudo 2, um estudo de tratamento agudo7 de 6 semanas, randomizado8, duplo-cego, controlado por placebo2, com crianças e adolescentes de 6 a 16 anos (N = 171), os pacientes receberam atomoxetina ou placebo2. A atomoxetina foi administrada em dose única no início da manhã e sua dose titulada com base no peso e de acordo com a resposta clínica, até uma dose máxima de 1,5 mg / kg / dia. A dose final média de atomoxetina foi de aproximadamente 1,3 mg / kg / dia. Houve uma melhora estatisticamente significativa nos sintomas5 do TDAH com o uso de atomoxetina comparado ao placebo2, conforme escala de avaliação ADHDRS. Este estudo mostra que a atomoxetina é eficaz quando administrado uma vez ao dia pela manhã.
Em 2 estudos idênticos, de 9 semanas, agudos, randomizados, duplo-cegos, controlados por placebo2 com crianças de 7 a 13 anos (Estudo 3, N = 147; Estudo 4, N = 144), atomoxetina e metilfenidato foram comparados com placebo2. A atomoxetina foi administrada em uma dose dividida pela manhã e ao final da tarde e titulada com base no peso de acordo com a resposta clínica. A dose máxima recomendada de atomoxetina foi de 2,0 mg / kg / dia. A dose final média de atomoxetina para ambos os estudos foi de aproximadamente 1,6 mg / kg / dia. Em ambos os estudos, os sintomas5 de TDAH apresentaram uma melhora estatisticamente superior com atomoxetina em comparação ao placebo2, conforme medido pela escala de avaliação ADHDRS.
O exame dos subconjuntos da população com base no sexo e na idade (<12 e 12 a 17) não revelou qualquer resposta diferencial com base nesses subgrupos. Não houve exposição suficiente de grupos étnicos diferentes de caucasianos para permitir a exploração das diferenças nesses subgrupos.
Estudo de Manutenção - A eficácia da atomoxetina no tratamento de manutenção do TDAH foi estabelecida em um estudo ambulatorial de crianças e adolescentes (idades de 6 a 15 anos). Pacientes que atenderam aos critérios do DSM-IV para TDAH que mostraram resposta contínua por cerca de 4 semanas durante uma fase inicial de tratamento aberto de 10 semanas com atomoxetina (1,2 a 1,8 mg / kg / dia) foram randomizados para a continuação de sua dose atual de atomoxetina (N = 292) ou placebo2 (N = 124) em tratamento duplo-cego para observação de recaída. A resposta durante a fase aberta foi definida como pontuação CGI-ADHD-S <2 e uma redução de pelo menos 25% em relação ao valor basal em “ADHDRS- IV-Parent:Inv total score”. Os pacientes que utilizaram atomoxetina e mostraram resposta contínua por aproximadamente 8 meses durante a primeira fase de tratamento duplo-cego foram novamente randomizados para a continuação de sua dose atual de atomoxetina (N = 81) ou para placebo2 (N = 82) sob tratamento duplo-cego para observação de recaída. A recaída durante a fase duplo-cega foi definida como aumentos de pontuação CGI-ADHD-S de pelo menos 2 desde o final da fase aberta e a pontuação total ADHDRS-IV-Parent:Inv retorna para ≥ 90% da pontuação de entrada no estudo por 2 visitas consecutivas. Em ambas as fases duplo-cegas, os pacientes que receberam tratamento contínuo com atomoxetina tiveram tempos de recaída significativamente mais longos do que aqueles que receberam placebo2.
Estudos de TDAH em Adultos
A eficácia da atomoxetina no tratamento do TDAH foi estabelecida em 2 estudos clínicos randomizados, duplo-cegos e controlados por placebo2 de pacientes adultos, com 18 anos ou mais, que preencheram os critérios do DSM-IV para TDAH.
Os sinais4 e sintomas5 de TDAH foram avaliados usando a versão de triagem da escala de classificação de TDAH de Conners administrada pelo investigador (CAARS), uma escala de 30 itens. A medida de eficácia primária foi a pontuação total de sintomas5 de TDAH de 18 itens (a soma das subescalas de desatenção e hiperatividade/impulsividade do CAARS) avaliada pela comparação da alteração média do início ao final do estudo, usando a análise por intenção de tratar.
Em 2 estudos de tratamento agudo7 idênticos, de 10 semanas, randomizados, duplo-cegos, controlados por placebo2 (Estudo 5, N = 280; Estudo 6, N = 256), os pacientes receberam atomoxetina ou placebo2. A atomoxetina foi administrada em uma dose dividida no início da manhã e no final da tarde / início da noite e titulada de acordo com a resposta clínica em um intervalo de 60 a 120 mg/dia. A dose final média de atomoxetina para ambos os estudos foi de aproximadamente 95 mg/dia. Em ambos os estudos, os sintomas5 de TDAH melhoraram de forma estatisticamente significativa no grupo que utilizou atomoxetina, conforme medido na pontuação de sintomas5 de TDAH da escala CAARS.
O exame dos subconjuntos da população com base no sexo e na idade (<42 e ≥42) não revelou qualquer resposta diferencial com base nesses subgrupos. Não houve exposição suficiente de grupos étnicos diferentes de caucasianos para permitir a exploração das diferenças nesses subgrupos.
CARACTERÍSTICAS FARMACOLÓGICAS
Mecanismo de Ação
O mecanismo preciso pelo qual a atomoxetina produz seus efeitos terapêuticos no Transtorno de Déficit de Atenção/Hiperatividade (TDAH) é desconhecido, mas acredita-se que esteja relacionado à inibição seletiva do transportador de norepinefrina pré-sináptica, conforme determinado em estudos ex vivo de captação e depleção9 de neurotransmissores.
Farmacodinâmica
Uma análise de exposição-resposta abrangendo doses de atomoxetina (0,5, 1,2 ou 1,8 mg/kg/dia) ou placebo2 demonstrou que a exposição à atomoxetina se correlaciona com a eficácia, conforme medido pela Escala de Classificação de Transtorno de Déficit de Atenção/Hiperatividade-IV-Versão dos Pais: administrado e pontuado pelo investigador. A relação exposição-eficácia foi semelhante à observada entre a dose e a eficácia.
Eletrofisiologia Cardíaca - O efeito de atomoxetina no prolongamento do QTc foi avaliado em um estudo cruzado randomizado8, duplo-cego, positivo (moxifloxacina 400 mg) e controlado por placebo2 em homens saudáveis metabolizadores pobres de CYP2D6. Um total de 120 indivíduos saudáveis receberam atomoxetina (20 mg e 60 mg) duas vezes ao dia durante 7 dias. Não foram observadas grandes alterações no intervalo QTc (ou seja, aumentos> 60 mseg a partir da linha de base, QTc absoluto> 480 mseg) no estudo. No entanto, pequenas alterações no intervalo QTc não podem ser excluídas do estudo atual, porque o estudo falhou em demonstrar a sensibilidade do ensaio. Houve um ligeiro aumento no intervalo QTc com o aumento da concentração de atomoxetina.
Farmacocinética
A atomoxetina é bem absorvida após administração oral e é minimamente afetada pelos alimentos. É eliminado principalmente pelo metabolismo10 oxidativo através da via enzimática do citocromo P450 2D6 (CYP2D6) e subsequente glucuronidação. A atomoxetina tem meia-vida de cerca de 5 horas. Uma fração da população (cerca de 7% dos caucasianos e 2% dos afro-americanos) são metabolizadores pobres (PMs) de drogas metabolizadas pelo CYP2D6. Esses indivíduos têm atividade reduzida nesta via, resultando em AUCs 10 vezes maiores, pico de concentrações plasmáticas 5 vezes maiores e eliminação mais lenta (meia-vida plasmática de cerca de 24 horas) da atomoxetina em comparação com pessoas com atividade normal [metabolizadores extensivos (EMs)]. Os medicamentos que inibem o CYP2D6, como a fluoxetina, a paroxetina e a quinidina, causam aumentos semelhantes na exposição.
A farmacocinética da atomoxetina foi avaliada em mais de 400 crianças e adolescentes em estudos clínicos selecionados, principalmente utilizando estudos farmacocinéticos populacionais. Dados farmacocinéticos individuais em dose única e em estado estacionário também foram obtidos em crianças, adolescentes e adultos. Quando as doses foram normalizadas para uma base de mg/kg, valores semelhantes de meia-vida, Cmax e AUC11 foram observados em crianças, adolescentes e adultos. A depuração e o volume de distribuição após o ajuste para o peso corporal também foram semelhantes.
Absorção e distribuição: A atomoxetina é rapidamente absorvida após administração oral, com biodisponibilidade absoluta de cerca de 63% em EMs e 94% em PMs. As concentrações plasmáticas máximas (Cmax) são atingidas aproximadamente 1 a 2 horas após a administração.
Atomoxetina pode ser administrada com ou sem alimentos. A administração de atomoxetina com uma refeição padrão rica em gordura12 em adultos não afetou a extensão da absorção oral da atomoxetina (AUC11), mas diminuiu a taxa de absorção, resultando em uma Cmax 37% mais baixa e um Tmax retardado em 3 horas. Em ensaios clínicos13 com crianças e adolescentes, a administração de atomoxetina com alimentos resultou numa Cmax 9% mais baixa.
O volume de distribuição no estado estacionário após a administração intravenosa é de 0,85 L/kg, indicando que a atomoxetina se distribui principalmente na água corporal total. O volume de distribuição é semelhante em toda a faixa de peso do paciente após a normalização pelo peso corporal.
Em concentrações terapêuticas, 98% da atomoxetina no plasma14 liga-se às proteínas15, principalmente à albumina16.
Metabolismo10 e eliminação: A atomoxetina é metabolizada principalmente pela via enzimática CYP2D6. Pessoas com atividade reduzida nesta via (PMs) têm maiores concentrações plasmáticas de atomoxetina em comparação com pessoas com atividade normal (EMs). Para PMs, a AUC11 da atomoxetina é aproximadamente 10 vezes e Css, max é cerca de 5 vezes maior do que EMs. A co-administração de atomoxetina com inibidores potentes do CYP2D6, como fluoxetina, paroxetina ou quinidina, resulta em um aumento substancial na exposição plasmática da atomoxetina e pode ser necessário ajuste da dose. A atomoxetina não inibiu ou induziu a via do CYP2D6.
O principal metabólito17 oxidativo formado, independentemente do status do CYP2D6, é a 4- hidroxiatomoxetina, que é glicuronidada. A 4-hidroxatomoxetina é equipotente à atomoxetina como um inibidor do transportador da norepinefrina, mas circula no plasma14 em concentrações muito mais baixas (1% da concentração de atomoxetina em EMs e 0,1% da concentração de atomoxetina em PMs). A 4- hidroxiatomoxetina é formada principalmente pelo CYP2D6, mas nos PMs, a 4-hidroxatomoxetina é formada em uma taxa mais lenta por várias outras enzimas do citocromo P450. A N-desmetilatomoxetina é formada pelo CYP2C19 e outras enzimas do citocromo P450, mas tem substancialmente menos atividade farmacológica em comparação com a atomoxetina e circula no plasma14 em concentrações mais baixas (5% da concentração de atomoxetina em EMs e 45% da concentração de atomoxetina em PMs). A depuração plasmática aparente média da atomoxetina após administração oral em adultos EMs é de 0,35 L/h/kg e a meia-vida média é de 5,2 horas. Após a administração oral de atomoxetina aos PMs, a depuração plasmática aparente média é de 0,03 L/h/kg e a meia-vida média é de 21,6 horas. Para PMs, a AUC11 da atomoxetina é aproximadamente 10 vezes e Css, max é cerca de 5 vezes maior do que EMs. A meia-vida de eliminação da 4-hidroxiatomoxetina é semelhante à da N-desmetilatomoxetina (6 a 8 horas) em indivíduos EM, enquanto a meia-vida de N-desmetilatomoxetina é muito maior em indivíduos PM (34 a 40 horas).
A atomoxetina é excretada principalmente como 4-hidroxatomoxetina-O-glicuronídeo, principalmente na urina18 (mais de 80% da dose) e em menor extensão nas fezes (menos de 17% da dose). Apenas uma pequena fração da dose de atomoxetina é excretada como atomoxetina inalterada (menos de 3% da dose), indicando extensa biotransformação.
Carcinogênese, Mutagênese, Diminuição da Fertilidade
Carcinogênese: O cloridrato de atomoxetina não foi carcinogênico em ratos e camundongos quando administrada na dieta por 2 anos em doses médias ponderadas de até 47 e 458 mg/kg/dia, respectivamente. A dose mais elevada usada em ratos é aproximadamente 8 e 5 vezes a dose humana máxima recomendada (MRHD) em crianças e adultos, respetivamente, numa base de mg/m2. Os níveis plasmáticos (AUC11) de atomoxetina nesta dose em ratos são estimados em 1,8 vezes (metabolizadores extensivos) ou 0,2 vezes (metabolizadores pobres) em humanos que recebem a dose humana máxima. A dose mais alta usada em camundongos é aproximadamente 39 e 26 vezes o MRHD em crianças e adultos, respectivamente, em uma base de mg/m2.
Mutagênese: O cloridrato de atomoxetina foi negativo em uma bateria de estudos de genotoxicidade que incluiu um ensaio de mutação19 de ponto reverso (Teste de Ames), um ensaio de linfoma20 de camundongo in vitro, um teste de aberração cromossômica em células21 de ovário22 de hamster chinês, um teste de síntese de DNA não programado em hepatócitos de rato, e um teste de micronúcleo in vivo em camundongos. No entanto, houve um ligeiro aumento na porcentagem de células21 de ovário22 de hamster chinês com diplocromossomos, sugerindo endreduplicação (aberração numérica).
O metabólito17 cloridrato de N-desmetilatomoxetina foi negativo no Teste de Ames, ensaio de linfoma20 em camundongo e teste de síntese de DNA não programado.
Diminuição da fertilidade: o cloridrato de atomoxetina não prejudicou a fertilidade em ratos quando administrada na dieta em doses de até 57 mg/kg/dia, que é aproximadamente 6 vezes o MRHD em uma base de mg/m2.
CONTRAINDICAÇÕES
Hipersensibilidade
Atentah é contraindicado em pacientes com hipersensibilidade à atomoxetina ou outros constituintes do produto.
Inibidores da Monoamina Oxidase (IMAO23)
Atentah não deve ser tomado com um IMAO23 ou dentro de 2 semanas após a interrupção de uso de um IMAO23. O tratamento com um IMAO23 não deve ser iniciado dentro de 2 semanas após a interrupção do uso de Atentah. Com outras drogas que afetam as concentrações de monoaminas cerebrais, houve relatos de reações graves, às vezes fatais (incluindo hipertermia, rigidez, mioclonia24, instabilidade autonômica com possíveis flutuações rápidas dos sinais vitais25 e alterações do estado mental que incluem agitação extrema que progride para delírio26 e coma27) quando tomado em combinação com um IMAO23. Alguns casos apresentaram características semelhantes à síndrome28 neuroléptica maligna. Essas reações podem ocorrer quando esses medicamentos são administrados concomitantemente ou em extrema proximidade.
Glaucoma29 de Ângulo Estreito
Em estudos clínicos, o uso de atomoxetina foi associado a um risco aumentado de midríase30 e, portanto, seu uso não é recomendado em pacientes com glaucoma29 de ângulo estreito.
Feocromocitoma31
Reações graves, incluindo pressão arterial32 elevada e taquiarritmia33, foram relatadas em pacientes com feocromocitoma31 ou história de feocromocitoma31 que receberam atomoxetina. Portanto, Atentah não deve ser administrado por pacientes com feocromocitoma31 ou história de feocromocitoma31.
Doenças Cardiovasculares34 Graves
Atentah não deve ser usado em pacientes com doenças cardíacas ou vasculares35 graves, cuja condição poderia piorar se experimentarem aumentos na pressão arterial32 ou frequência cardíaca que poderiam ser clinicamente importantes (por exemplo, 15 a 20 mm Hg na pressão arterial32 ou 20 batimentos por minuto na frequência cardíaca).
Hipertireoidismo36 não controlado
Indivíduos com hipertireoidismo36 apresentam sintomas5 como hiperatividade, irritabilidade, alterações de humor, insônia, ansiedade etc. Alguns estudos observam que os efeitos adversos da atomoxetina, como alterações de humor, irritabilidade, insônia, arritmia37, assemelham-se aos sintomas5 do hipertireoidismo36. Devido às semelhanças entre os sintomas5 do hipertireoidismo36 e os efeitos adversos da atomoxetina, as alterações nos níveis de hormônio38 tireoidiano podem não ser reconhecidas em pacientes em tratamento com atomoxetina, sendo seu uso em pacientes com hipertireoidismo36 não controlado contraindicado.
Este medicamento é contraindicado para menores de 6 anos
ADVERTÊNCIAS E PRECAUÇÕES
Pensamento Suicida
Atomoxetina aumentou o risco de pensamento suicida em estudos de curto prazo em crianças e adolescentes com Transtorno de Déficit de Atenção/Hiperatividade (TDAH). Análises agrupadas de estudos clínicos de curto prazo controlados por placebo2 (6 a 18 semanas) de atomoxetina em crianças e adolescentes revelaram um maior risco de pensamento suicida no início do tratamento em pacientes que receberam atomoxetina. Houve um total de 12 estudos (11 em TDAH e 1 em enurese39) envolvendo mais de 2.200 pacientes (incluindo 1.357 pacientes recebendo atomoxetina e 851 recebendo placebo2). O risco médio de pensamento suicida em pacientes recebendo atomoxetina foi de 0,4% (5/1357 pacientes), em comparação com nenhum em pacientes tratados com placebo2. Houve 1 tentativa de suicídio entre esses aproximadamente 2.200 pacientes, ocorrendo em um paciente tratado com atomoxetina. Nenhum suicídio ocorreu nesses estudos. Todas as reações ocorreram em crianças com idade igual ou inferior a 12 anos. Todas as reações ocorreram durante o primeiro mês de tratamento. Não se sabe se o risco de pensamento suicida em pacientes pediátricos se estende ao uso de longo prazo. Uma análise semelhante em pacientes adultos tratados com atomoxetina para TDAH ou transtorno depressivo maior (TDM) não revelou um risco aumentado de pensamento ou comportamento suicida em associação com o uso de atomoxetina.
Todos os pacientes em tratamento com atomoxetina devem ser monitorados adequadamente e observados atentamente quanto a agravamento clínico, tendências suicidas e alterações incomuns no comportamento, especialmente durante os primeiros meses da terapia medicamentosa ou em períodos de mudanças de dose, tanto aumento quanto diminuição.
Os seguintes sintomas5 foram relatados com atomoxetina: ansiedade, agitação, ataques de pânico, insônia, irritabilidade, hostilidade, agressividade, impulsividade, acatisia40 (inquietação psicomotora41), hipomania e mania. Embora não tenha sido estabelecido um nexo de causalidade entre o surgimento desses sintomas5 e o surgimento de impulsos suicidas, existe a preocupação de que esses sintomas5 possam ser precursores do aparecimento de pensamentos suicidas. Portanto, os pacientes em tratamento com atomoxetina devem ser observados quanto ao surgimento de tais sintomas5.
Deve-se considerar a alteração do regime terapêutico, incluindo a possível descontinuação da medicação, em pacientes que estão apresentando tendências suicidas ou sintomas5 que podem ser precursores de tendências suicidas, especialmente se esses sintomas5 forem graves ou de início abrupto, ou se não fizessem parte dos sintomas5 presentes do paciente.
Famílias e cuidadores de pacientes pediátricos em tratamento com atomoxetina devem ser alertados sobre a necessidade de monitorar os pacientes quanto ao surgimento de agitação, irritabilidade, mudanças incomuns no comportamento e outros sintomas5 descritos acima, bem como o surgimento de tendência suicida e relatar tais sintomas5 imediatamente aos profissionais de saúde1. Esse monitoramento deve incluir observação diária por familiares e cuidadores.
Lesões42 Hepáticas43 Graves
Relatos pós-comercialização indicam que atomoxetina pode causar lesões42 hepáticas43 graves. Embora nenhuma evidência de lesão44 hepática45 tenha sido detectada em estudos clínicos com cerca de 6.000 pacientes, houve casos raros de lesão44 hepática45 clinicamente significativa que foram considerados provavelmente ou possivelmente relacionados ao uso de atomoxetina na experiência pós- comercialização. Também foram relatados casos raros de insuficiência hepática46, incluindo um caso que resultou em um transplante de fígado47. Devido à provável subnotificação, é impossível fornecer uma estimativa precisa da verdadeira incidência48 dessas reações. Casos relatados de lesão44 hepática45 ocorreram dentro de 120 dias do início da atomoxetina na maioria dos casos e alguns pacientes apresentaram enzimas hepáticas49 marcadamente elevadas [> 20 X limite superior do normal (LSN)] e icterícia50 com níveis de bilirrubina51 significativamente elevados (> 2 X LSN), seguido de recuperação após a descontinuação da atomoxetina. Em um paciente, a lesão44 hepática45, manifestada por enzimas hepáticas49 elevadas até 40 X LSN e icterícia50 com bilirrubina51 até 12 X LSN, reapareceu após a reintrodução e foi seguida por recuperação após a descontinuação do medicamento, fornecendo evidências de que atomoxetina provavelmente causou a lesão44 hepática45. Essas reações podem ocorrer vários meses após o início da terapia, mas as anormalidades laboratoriais podem continuar a piorar por várias semanas após a interrupção do medicamento. O paciente descrito acima se recuperou de sua lesão44 hepática45 e não precisou de um transplante de fígado47.
Atomoxetina deve ser descontinuada em pacientes com icterícia50 ou evidências laboratoriais de lesão44 hepática45 e não deve ser reiniciado. Os exames laboratoriais para determinar os níveis de enzimas hepáticas49 devem ser realizados após o primeiro sintoma6 ou sinal52 de disfunção hepática45 (por exemplo, prurido53, urina18 escura, icterícia50, sensibilidade no quadrante superior direito ou sintomas5 inexplicáveis de “gripe”).
Eventos Cardiovasculares Graves
Morte Súbita e Anormalidades Cardíacas Estruturais Pré-existentes ou Outros Problemas Cardíacos Graves
Crianças e adolescentes – A morte súbita foi relatada em associação com o tratamento com atomoxetina em doses usuais em crianças e adolescentes com anomalias cardíacas estruturais ou outros problemas cardíacos graves. Embora alguns problemas cardíacos graves por si só representem um risco aumentado de morte súbita, a atomoxetina geralmente não deve ser usada em crianças ou adolescentes com anomalias estruturais cardíacas graves conhecidas, cardiomiopatia, anormalidades graves do ritmo cardíaco ou outros problemas cardíacos graves que podem aumentar a vulnerabilidade aos efeitos noradrenérgicos da atomoxetina.
Adultos – Morte súbita, acidente vascular cerebral54 e infarto do miocárdio55 foram relatados em adultos tomando atomoxetina em doses usuais para TDAH. Embora o papel da atomoxetina nesses casos em adultos também seja desconhecido, os adultos têm maior probabilidade do que as crianças de apresentarem anormalidades cardíacas estruturais graves, cardiomiopatia, anormalidades graves do ritmo cardíaco, doença arterial coronariana ou outros problemas cardíacos graves. Deve-se considerar o não tratamento de adultos com anormalidades cardíacas clinicamente significativas.
Avaliação do Estado Cardiovascular em Pacientes Tratados com Atomoxetina
Crianças, adolescentes ou adultos que estão sendo considerados para tratamento com atomoxetina devem passar por um exame físico e de histórico cuidadoso (incluindo avaliação de histórico familiar de morte súbita ou arritmia37 ventricular) para avaliar a presença de doença cardíaca, e devem realizar posterior avaliação cardíaca se os achados sugerirem tal doença (por exemplo, eletrocardiograma56 e ecocardiograma57). Os pacientes que desenvolverem sintomas5 como dor no peito58 por esforço, síncope59 inexplicada ou outros sintomas5 sugestivos de doença cardíaca durante o tratamento com atomoxetina devem ser submetidos a uma avaliação cardíaca imediata.
Efeitos Sobre a Pressão Arterial32 e Frequência Cardíaca
A atomoxetina deve ser usada com cautela em pacientes cujas condições médicas subjacentes podem ser agravadas por aumentos na pressão arterial32 ou frequência cardíaca, como certos pacientes com hipertensão60, taquicardia61 ou doença cardiovascular ou cerebrovascular. Não deve ser utilizado em pacientes com doenças cardíacas ou vasculares35 graves, cuja situação possa ser agravada caso apresentem aumentos clinicamente importantes da pressão arterial32 ou frequência cardíaca. O pulso e a pressão arterial32 devem ser medidos no início do tratamento, após aumentos da dose de atomoxetina e periodicamente durante a terapia para detectar possíveis aumentos clinicamente importantes.
A tabela a seguir fornece dados de estudos clínicos de curto prazo controlados por placebo2 para as proporções de pacientes com aumento em: pressão arterial diastólica62 ≥ 15 mm Hg; pressão arterial sistólica63 ≥ 20 mm Hg; frequência cardíaca maior ou igual a 20 bpm, tanto na população pediátrica quanto na adulta (ver Tabela 1).
Tabela 1 – Dados de estudos clínicos de curto prazo sobre os efeitos na pressão arterial32 e frequência cardíaca
|
|
Pediátrico agudo7 – placebo2-controlado |
Adulto agudo7 – placebo2 controlado |
||||||
|
Máximob |
Critério de Avaliação |
Máximob |
Critério de Avaliação |
|||||
|
Atomoxetina |
Placebo2 |
Atomoxetina |
Placebo2 |
Atomoxetina |
Placebo2 |
Atomoxetina |
Placebo2 |
|
|
PAD (≥ 15 mm Hg) |
21.5 |
14.1 |
9.3 |
4.8 |
12.6 |
8.7 |
4.8 |
3.5 |
|
PAS (≥ 20 mm Hg) |
12.5 |
8.7 |
4.9 |
3.3 |
12.4 |
7.8 |
4.2 |
3.2 |
|
FC (≥ 20 bpm) |
23.4 |
11.5 |
12.2 |
3.8 |
22.4 |
8.3 |
10.2 |
2.0 |
a Abreviações: bpm = batimentos por minuto; PAD = pressão arterial diastólica62; FC = frequência cardíaca; mm Hg = milímetros de mercúrio; PAS = pressão arterial sistólica63.
b Proporção de pacientes que atingem o limiar em qualquer momento durante o ensaio clínico.
Em estudos para registro controlados por placebo2 envolvendo pacientes pediátricos, a taquicardia61 foi identificada como um evento adverso em 0,3% (5/1597) desses pacientes com atomoxetina em comparação com 0% (0/934) dos pacientes com placebo2. O aumento médio da frequência cardíaca em pacientes com metabolizador extensivo (EM) foi de 5,0 batimentos/minuto, e em pacientes com metabolizador pobre (PM), 9,4 batimentos/minuto.
Em estudos clínicos em adultos onde a condição EM/PM estava disponível, o aumento médio da frequência cardíaca em pacientes com PM foi significativamente maior do que em pacientes com EM (11 batimentos/minuto versus 7,5 batimentos/minuto). Os efeitos da frequência cardíaca podem ser clinicamente importantes em alguns pacientes PM.
Em estudos para registro controlados por placebo2 envolvendo pacientes adultos, a taquicardia61 foi identificada como um evento adverso em 1,5% (8/540) dos pacientes com atomoxetina em comparação com 0,5% (2/402) dos pacientes com placebo2.
Em estudos clínicos em adultos onde a condição EM/PM estava disponível, a mudança média da linha de base na pressão arterial diastólica62 em pacientes com PM foi maior do que em pacientes com EM (4,21 versus 2,13 mm Hg) como foi a mudança média da linha de base na pressão arterial sistólica63 (PM: 2,75 versus EM: 2,40 mm Hg).Os efeitos da pressão arterial32 podem ser clinicamente importantes em alguns pacientes PM.
Hipotensão64 ortostática e síncope59 foram relatadas em pacientes utilizando atomoxetina. Em estudos para registro de crianças e adolescentes, 0,2% (12/5596) dos pacientes tratados com atomoxetina apresentaram hipotensão64 ortostática e 0,8% (46/5596) apresentaram síncope59. Em estudos para registro de crianças e adolescentes de curto prazo, 1,8% (6/340) dos pacientes tratados com atomoxetina apresentaram hipotensão64 ortostática em comparação com 0,5% (1/207) dos pacientes tratados com placebo2. A síncope59 não foi relatada durante estudos de curto prazo para registro, placebo2 controlados, em crianças e adolescentes com TDAH. A atomoxetina deve ser usada com cuidado em qualquer condição que possa predispor os pacientes à hipotensão64 ou condições associadas a alterações abruptas da frequência cardíaca ou da pressão arterial32.
Emergência65 de Novos Sintomas5 Psicóticos ou Maníacos
O tratamento de sintomas5 psicóticos ou maníacos emergentes, como por exemplo, alucinações66, pensamento delirante ou mania em crianças e adolescentes sem histórico prévio de doença psicótica ou mania, podem ser causados pela atomoxetina em doses usuais. Se tais sintomas5 ocorrerem, deve-se considerar um possível papel causal da atomoxetina, e a descontinuação do tratamento deve ser considerada. Em uma análise conjunta de vários estudos de curto prazo controlados por placebo2, tais sintomas5 ocorreram em cerca de 0,2% (4 pacientes com reações dentre 1939 expostos à atomoxetina por várias semanas em doses usuais) de pacientes tratados com atomoxetina em comparação com 0 de 1.056 pacientes tratados com placebo2.
Triagem de Pacientes para Transtorno Bipolar
Em geral, deve-se ter cuidado especial no tratamento de TDAH em pacientes com transtorno bipolar comórbido devido à preocupação com a possível indução de um episódio misto/maníaco em pacientes com risco de transtorno bipolar. Não se sabe se algum dos sintomas5 descritos acima representa tal conversão. No entanto, antes de iniciar o tratamento com atomoxetina, os pacientes com sintomas5 depressivos comórbidos devem ser examinados adequadamente para determinar se estão em risco de transtorno bipolar; esse rastreamento deve incluir um histórico psiquiátrico detalhado, incluindo histórico familiar de suicídio, transtorno bipolar e depressão.
Comportamento Agressivo ou Hostilidade
Pacientes que iniciam o tratamento para TDAH devem ser monitorados quanto ao aparecimento ou agravamento de comportamento agressivo ou hostilidade. O comportamento agressivo ou hostilidade é frequentemente observado em crianças e adolescentes com TDAH. Em estudos clínicos pediátricos de curto prazo controlados, 21/1308 (1,6%) dos pacientes tratados com atomoxetina versus 9/806 (1,1%) dos pacientes tratados com placebo2 relataram espontaneamente eventos adversos relacionados à hostilidade emergentes do tratamento (razão de risco geral de 1,33 [95% C.I. 0,67-2,64 - não estatisticamente significativo]). Em ensaios clínicos13 controlados com placebo2 em adultos, 6/1697 (0,35%) dos pacientes tratados com atomoxetina versus 4/1560 (0,26%) dos pacientes tratados com placebo2 relataram espontaneamente eventos adversos relacionados à hostilidade emergente do tratamento (razão de risco geral de 1,38 [C.I. 95% 0,39-4,88 - não estatisticamente significativo]). Embora não seja uma evidência conclusiva de que atomoxetina cause comportamento agressivo ou hostilidade, esses comportamentos foram observados com mais frequência em estudos clínicos entre crianças, adolescentes e adultos tratados com atomoxetina em comparação com placebo2.
Eventos alérgicos
Embora incomuns, reações alérgicas, incluindo reações anafiláticas67, edema angioneurótico68, urticária69 e erupção70 cutânea71, foram relatadas em pacientes tomando atomoxetina.
Efeitos Sobre o Fluxo Urinário da Bexiga72
Em estudos controlados em adultos com TDAH, as taxas de retenção urinária73 (1,7%, 9/540) e hesitação urinária (5,6%, 30/540) aumentaram entre os indivíduos que utilizaram atomoxetina em comparação com os indivíduos que receberam placebo2 (0%, 0/402; 0,5%, 2/402, respectivamente). Dois sujeitos adultos que receberam atomoxetina e nenhum sujeito que recebeu placebo2 descontinuaram os estudos clínicos controlados por causa da retenção urinária73. Uma queixa de retenção urinária73 ou hesitação urinária deve ser considerada potencialmente relacionada à atomoxetina.
Priapismo74
Casos raros de priapismo74 pós-comercialização, definidos como ereção75 peniana dolorosa e não dolorosa com duração superior a 4 horas, foram relatados por pacientes pediátricos e adultos tratados com atomoxetina. As ereções foram resolvidas nos casos em que havia informações de acompanhamento disponíveis, alguns após a descontinuação de atomoxetina. É necessária atenção médica imediata em caso de suspeita de priapismo74.
Efeitos Sobre o Crescimento
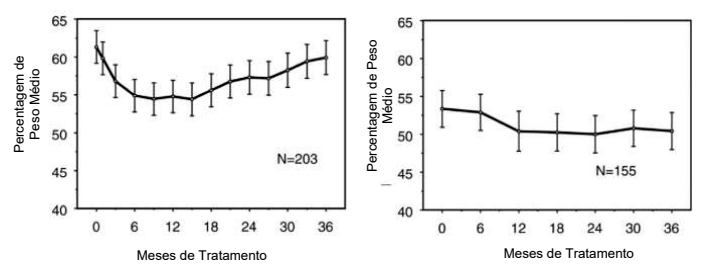
Os dados sobre os efeitos a longo prazo de atomoxetina no crescimento vêm de estudos abertos e as alterações de peso e altura são comparadas com dados populacionais normativos. Em geral, o ganho de peso e altura de pacientes pediátricos tratados com atomoxetina fica aquém do previsto por dados populacionais normativos por cerca dos primeiros 9-12 meses de tratamento. Posteriormente, o ganho de peso voltou e, em cerca de 3 anos de tratamento, os pacientes tratados com atomoxetina ganharam 17,9 kg em média, 0,5 kg a mais do que o previsto por seus dados base. Após cerca de 12 meses, o ganho de altura se estabiliza e, em 3 anos, os pacientes tratados com atomoxetina ganharam 19,4 cm em média, 0,4 cm a menos do que o previsto por seus dados de linha de base (ver Figura 1 abaixo).
Figura 1: Percentagem Média de Peso e Altura ao Longo do Tempo para Pacientes76 com Três Anos de Tratamento com atomoxetina
Este padrão de crescimento foi geralmente semelhante, independentemente do estado puberal no momento do início do tratamento. Pacientes que estavam na pré-puberdade no início do tratamento (meninas ≤ 8 anos, meninos ≤ 9 anos) ganharam em média 2,1 kg e 1,2 cm menos do que o previsto após três anos. Pacientes que estavam na puberdade (meninas > 8 a ≤ 13 anos, meninos > 9 a ≤ 14 anos) ou na puberdade tardia (meninas > 13 anos, meninos > 14 anos) tiveram ganhos médios de peso e altura próximos do previsto ou ultrapassou os previstos após três anos de tratamento.
O crescimento seguiu um padrão semelhante tanto em metabolizadores extensivos quanto em metabolizadores pobres (EMs, PMs). PMs tratados por pelo menos dois anos ganharam uma média de 2,4 kg e 1,1 cm menos do que o previsto, enquanto os EMs ganharam uma média de 0,2 kg e 0,4 cm menos do que o previsto.
Em estudos controlados de curto prazo (até 9 semanas), os pacientes tratados com atomoxetina perderam em média 0,4 kg e ganharam em média 0,9 cm, em comparação com um ganho de 1,5 kg e 1,1 cm nos pacientes tratados com placebo2. Em um estudo clínico controlado com dose fixa, 1,3%, 7,1%, 19,3% e 29,1% dos pacientes perderam pelo menos 3,5% do peso corporal nos grupos de dose com placebo2, 0,5, 1,2 e 1,8 mg/kg/dia.
O crescimento deve ser monitorizado durante o tratamento com atomoxetina.
Testes de Laboratório: Não são necessários testes laboratoriais de rotina.
Metabolismo10 de CYP2D6: Metabolizadores pobres (PMs) de CYP2D6 têm uma AUC11 10 vezes maior e um pico de concentração 5 vezes maior para uma determinada dose de atomoxetina em comparação com metabolizadores extensivos (EMs). Aproximadamente 7% da população caucasiana são PMs. Os testes de laboratório estão disponíveis para identificar PMs CYP2D6. Os níveis sanguíneos dos PMs são semelhantes aos obtidos com o uso de inibidores fortes do CYP2D6. Os níveis sanguíneos mais elevados em PMs levam a uma taxa mais alta de alguns efeitos adversos da atomoxetina.
Uso Concomitante de Inibidores Potentes do CYP2D6 ou Uso em Pacientes que são conhecidos como PMs do CYP2D6: A atomoxetina é metabolizada principalmente pela via CYP2D6 em 4-hidroxiatomoxetina. O ajuste posológico de atomoxetina pode ser necessário quando coadministrado com inibidores potentes do CYP2D6 (por exemplo, paroxetina, fluoxetina e quinidina) ou quando administrado aos PMs do CYP2D6.
Gravidez77 e Lactação78
Não foram realizados estudos apropriados e bem controlados com atomoxetina em mulheres grávidas. Atentah não deve ser usado durante a gravidez77, a menos que o benefício esperado justifique o risco potencial para o feto79.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião dentista.
Os estudos disponíveis publicados com uso de atomoxetina em mulheres grávidas são insuficientes para estabelecer um risco de grandes defeitos de nascença, aborto espontâneo ou resultados maternais ou fetais adversos associado à droga.
Alguns estudos de reprodução80 animal com atomoxetina tiveram resultados adversos no desenvolvimento. Um dos 3 estudos em coelhas grávidas que receberam atomoxetina durante a organogênese resultou na diminuição de fetos vivos e um aumento nas reabsorções precoces, bem como ligeiros aumentos nas incidências na origem da artéria81 carótida atípica e artéria81 subclávia ausente. Estes efeitos foram observados em níveis plasmáticos (AUC11) 3 vezes e 0,4 vezes os níveis plasmáticos humanos em metabolizadores pobres e extensivos recebendo a dose humana máxima recomendada (MRHD), respectivamente. Em ratos que receberam a atomoxetina antes do acasalamento e durante a organogênese, foi observada uma diminuição no peso fetal (apenas fêmeas) e um aumento na incidência48 de ossificação incompleta do arco vertebral em fetos com uma dose de aproximadamente 5 vezes o MRHD em uma base de mg/m2. Em um dos 2 estudos nos quais os ratos receberam a atomoxetina antes do acasalamento até os períodos de organogênese e lactação78, observou-se diminuição do peso dos filhotes e diminuição da sobrevida82 dos filhotes em doses correspondentes a 5-6 vezes o MRHD em uma base de mg/m2. Nenhum efeito fetal adverso foi observado em ratas grávidas que receberam a atomoxetina durante o período de organogênese.
O risco estimado de antecedentes de grandes defeitos congênitos83 e aborto espontâneo para a população indicada é desconhecido. Todas as gestações têm um risco de antecedentes de defeito de nascença, perda ou outros resultados adversos. Na população geral dos EUA, o risco estimado conhecido de grandes defeitos congênitos83 e abortos espontâneos em gravidezes clinicamente reconhecidas é 2-4% e 15-20%, respectivamente.
Dados de uso em animais
Coelhas grávidas foram tratadas com até 100 mg/kg/dia de atomoxetina por gavagem durante todo o período de organogênese. Com esta dose, em 1 de 3 estudos, foi observada uma diminuição nos fetos vivos e um aumento nas reabsorções precoces. Foram observados ligeiros aumentos nas incidências de origem atípica da artéria81 carótida e ausência da artéria81 subclávia. Esses achados foram observados em doses que causaram leve toxicidade84 materna. A dose sem efeito para esses achados foi de 30 mg/kg/dia. A dose de 100 mg/kg é aproximadamente 23 vezes o MRHD em uma base de mg/m2; os níveis plasmáticos (AUC11) de atomoxetina nesta dose em coelhos são estimados em 3,3 vezes (metabolizadores extensivos) ou 0,4 vezes (metabolizadores pobres) em humanos recebendo o MRHD.
Os ratos foram tratados com até aproximadamente 50 mg/kg/dia de atomoxetina (aproximadamente 6 vezes o MRHD em uma base de mg/m2) na dieta de 2 semanas (fêmeas) ou 10 semanas (machos) antes do acasalamento até os períodos de organogênese e lactação78. Em 1 de 2 estudos, foram observadas diminuições no peso e na sobrevivência85 dos filhotes. A diminuição da sobrevivência85 dos filhotes também foi observada com 25 mg/kg (mas não com 13 mg/kg). Em um estudo no qual os ratos foram tratados com atomoxetina na dieta por 2 semanas (fêmeas) ou 10 semanas (machos) antes do acasalamento até todo o período de organogênese, uma diminuição no peso fetal (apenas fêmeas) e um aumento na incidência48 de ossificação incompleta do arco vertebral em fetos foi observada com 40 mg/kg/dia (aproximadamente 5 vezes o MRHD em uma base de mg/m2), mas não com 20 mg/kg/dia.
Nenhum efeito fetal adverso foi observado quando ratas grávidas foram tratadas com até 150 mg/kg/dia (aproximadamente 17 vezes o MRHD em uma base de mg/m2) por sonda esofágica durante todo o período de organogênese.
Lactação78
Não existem dados sobre a presença de atomoxetina ou de seu metabólito17 no leite humano, os efeitos na criança amamentada ou na produção de leite. A atomoxetina está presente no leite animal. Quando um medicamento está presente no leite animal, é provável que esteja presente no leite humano.
Os benefícios para o desenvolvimento e a saúde1 da criança devem ser considerados juntamente com a necessidade clínica da mãe de utilizar atomoxetina e quaisquer potenciais efeitos adversos da atomoxetina sobre a criança ou da condição materna subjacente.
Populações especiais
Uso Pediátrico: Qualquer pessoa que esteja considerando o uso de atomoxetina em uma criança ou adolescente deve avaliar a relação entre os potenciais riscos e a necessidade clínica.
A farmacocinética da atomoxetina em crianças e adolescentes é semelhante à dos adultos. A segurança, eficácia e farmacocinética de atomoxetina em pacientes pediátricos com menos de 6 anos de idade não foram avaliadas.
Um estudo foi conduzido em ratos jovens para avaliar os efeitos da atomoxetina no crescimento e no desenvolvimento neurocomportamental e sexual. Os ratos foram tratados com 1, 10 ou 50 mg/kg/dia (aproximadamente 0,2, 2 e 8 vezes, respectivamente, a dose humana máxima com base em mg/m2) de atomoxetina administrada por gavagem desde o período pós-natal inicial (Dia 10 de idade) até a idade adulta. Ligeiros atrasos no início da patência vaginal (todas as doses) e separação prepucial (10 e 50 mg/kg), ligeiras diminuições no peso do epidídimo86 e no número de espermatozoides87 (10 e 50 mg / kg), e uma ligeira diminuição nos corpos lúteos (50 mg/kg) foram observados, mas não houve efeitos na fertilidade ou desempenho reprodutivo. Um ligeiro atraso no início da erupção70 dos incisivos foi observado com 50 mg/kg. Um ligeiro aumento na atividade motora foi observado no dia 15 (homens com 10 e 50 mg/kg e mulheres com 50 mg/kg) e no dia 30 (mulheres com 50 mg/kg), mas não no dia 60 de idade. Não houve efeitos nos testes de aprendizagem e memória. Desconhece-se qual o significado destes achados para o ser humano.
Uso em idosos: A segurança, eficácia e farmacocinética de atomoxetina em pacientes geriátricos não foram avaliadas.
Insuficiência Hepática46: A exposição à atomoxetina (AUC11) está aumentada, em comparação com indivíduos normais, em indivíduos EM com insuficiência hepática46 moderada (Child-Pugh classe B) (aumento de 2 vezes) e grave (Child-Pugh classe C) (aumento de 4 vezes). O ajuste da dose é recomendado para pacientes76 com insuficiência hepática46 moderada ou grave.
Insuficiência Renal88: Indivíduos EM com doença renal89 em estágio terminal tiveram maior exposição sistêmica à atomoxetina do que indivíduos saudáveis (aumento de cerca de 65%), mas não houve diferença quando a exposição foi corrigida para a dose de mg/kg. A atomoxetina pode, portanto, ser administrado a pacientes com TDAH com doença renal89 em estágio terminal ou graus menores de insuficiência renal88 usando o regime de dosagem normal.
Gênero e origem étnica: O gênero não influenciou a farmacocinética da atomoxetina.
A origem étnica não influenciou a farmacocinética da atomoxetina (exceto que os PMs são mais comuns em caucasianos).
Pacientes com Doença Concomitante
Tiques em pacientes com TDAH e transtorno de Tourette comórbido: a atomoxetina administrada em uma faixa de dose flexível de 0,5 a 1,5 mg/kg/dia (dose média de 1,3 mg/kg/dia) e placebo2 foram comparados em 148 pacientes pediátricos randomizados (idade 7 a 17 anos) com diagnóstico3 DSM-IV de TDAH e comorbidade90 de tique91 nervoso em um estudo duplo-cego92 controlado por placebo2 de 18 semanas no qual a maioria dos voluntários (80%) se inscreveu neste estudo com Transtorno de Tourette (Transtorno de Tourette: 116 sujeitos; transtorno de tique91 motor crônico93: 29 indivíduos). Uma análise de não inferioridade revelou que a atomoxetina não piorou os tiques nesses pacientes, conforme determinado pela Escala Global de Gravidade de Tique91 de Yale (EGGTY). Dos 148 pacientes que entraram na fase aguda de tratamento, 103 (69,6%) pacientes descontinuaram o estudo. A principal razão para a descontinuação em ambos os grupos de tratamento com atomoxetina (38 de 76 pacientes, 50,0%) e placebo2 (45 de 72 pacientes, 62,5%) foi identificada como falta de eficácia com a maioria dos pacientes descontinuando na semana 12. Esta foi a primeira visita em que os pacientes com CGI-S ≥ 4 também puderam atender aos critérios de "não respondedor clínico" (CGI-S permaneceu o mesmo ou aumentou desde a linha de base do estudo) e foram elegíveis para entrar em um estudo aberto de extensão com atomoxetina. Houve relatos pós- comercialização de tiques.
Ansiedade em pacientes com TDAH e transtornos de ansiedade comórbidos: Em dois estudos pós- comercialização, duplo-cegos, controlados por placebo2, foi demonstrado que o tratamento de pacientes com TDAH e transtornos de ansiedade comórbidos com atomoxetina não piora sua ansiedade.
Em um estudo duplo-cego92 controlado por placebo2 de 12 semanas, 176 pacientes, com idades entre 8-17, que preencheram os critérios do DSM-IV para TDAH e pelo menos um dos transtornos de ansiedade do transtorno de ansiedade de separação, transtorno de ansiedade generalizada ou fobia94 social foram randomizados. Após um período inicial de tratamento duplo-cego com placebo2 de 2 semanas, atomoxetina foi iniciada com 0,8 mg/kg/dia com aumento para uma dose-alvo de 1,2 mg/kg/dia (dose mediana de 1,30 mg/kg/dia +/- 0,29 mg/kg/dia). A atomoxetina não piorou a ansiedade nesses pacientes, conforme determinado pela Escala de Avaliação de Ansiedade Pediátrica (EAAP). Dos 158 pacientes que completaram a introdução duplo-cego com placebo2, 26 (16%) pacientes descontinuaram o estudo.
Em um ensaio separado de 16 semanas, duplo-cego e controlado por placebo2, 442 pacientes com idades entre 18-65 anos, que preencheram os critérios do DSM-IV para TDAH adulto e transtorno de ansiedade social (23% dos quais também tinham transtorno de ansiedade generalizada) foram randomizados. Após uma introdução duplo-cego de placebo2 de 2 semanas, a atomoxetina foi iniciada com 40 mg/dia até uma dose máxima de 100 mg/dia (dose média diária de 83 mg/dia +/- 19,5 mg/dia). A atomoxetina não piorou a ansiedade nesses pacientes, conforme determinado pela Escala de Ansiedade Social de Liebowitz (EASL). Dos 413 pacientes que completaram a introdução duplo-cega com placebo2, 149 (36,1%) pacientes descontinuaram o estudo. Houve relatos pós-comercialização de ansiedade.
Abuso
Em um estudo de potencial de abuso, randomizado8, duplo-cego, controlado por placebo2 em adultos comparando os efeitos de atomoxetina e placebo2, a atomoxetina não foi associada a um padrão de resposta que sugerisse propriedades estimulantes ou euforizantes.
Dependência
Dados de estudos clínicos em mais de 2.000 crianças, adolescentes e adultos com TDAH e mais de 1.200 adultos com depressão mostraram apenas incidentes95 isolados de desvio do medicamento ou associados a autoadministração inadequada de atomoxetina. Não houve evidência de sintomas5 rebote ou reações adversas sugerindo descontinuação do medicamento ou síndrome28 de abstinência.
Este medicamento pode potencializar o prolongamento do intervalo QT, o que aumenta o risco de ataque de arritmias96 ventriculares graves do tipo “torsades de pointes”, que é potencialmente fatal (morte súbita).
INTERAÇÕES MEDICAMENTOSAS
Inibidores da Monoamina Oxidase
Com outras drogas que afetam as concentrações de monoaminas cerebrais, houve relatos de reações graves, às vezes fatais (incluindo hipertermia, rigidez, mioclonia24, instabilidade autonômica com possíveis flutuações rápidas dos sinais vitais25 e alterações do estado mental que incluem agitação extrema que progride para delírio26 e coma27) quando tomado em combinação com um IMAO23. Alguns casos apresentaram características semelhantes à síndrome28 neuroléptica maligna. Essas reações podem ocorrer quando estes medicamentos são administrados concomitantemente ou em horários muito próximos.
Efeito dos Inibidores da CYP2D6 na Atomoxetina
Em metabolizadores extensivos (EMs), os inibidores de CYP2D6 (por exemplo, paroxetina, fluoxetina e quinidina) aumentam as concentrações plasmáticas de atomoxetina em estado estacionário para exposições semelhantes às observadas em metabolizadores pobres (PMs). Em indivíduos EM tratados com paroxetina ou fluoxetina, a AUC11 da atomoxetina é aproximadamente 6 a 8 vezes e Css, max é cerca de 3 a 4 vezes maior do que a atomoxetina sozinha.
Estudos in vitro sugerem que a coadministração de inibidores do citocromo P450 aos PMs não aumenta as concentrações plasmáticas de atomoxetina.
Medicamentos Anti-hipertensivos e Agentes Pressores
Devido aos possíveis efeitos sobre a pressão arterial32, a atomoxetina deve ser usada com cautela com medicamentos anti-hipertensivos e agentes pressores (por exemplo, dopamina97, dobutamina) ou outros medicamentos que aumentam a pressão arterial32.
Albuterol
A atomoxetina deve ser administrada com cautela a pacientes em tratamento com albuterol administrado sistemicamente (oral ou intravenoso) (ou outros agonistas beta2) porque a ação do albuterol no sistema cardiovascular98 pode ser potencializada, resultando em aumentos da frequência cardíaca e da pressão arterial32. O albuterol (600 mcg iv por 2 horas) induziu aumentos na frequência cardíaca e na pressão arterial32. Esses efeitos foram potencializados pela atomoxetina (60 mg BID por 5 dias) e foram mais marcados após a coadministração inicial de albuterol e atomoxetina. No entanto, esses efeitos na frequência cardíaca e pressão arterial32 não foram observados em outro estudo após a coadministração com dose inalada de albuterol (200-800 mcg) e atomoxetina (80 mg QD por 5 dias) em 21 indivíduos asiáticos saudáveis que foram excluídos por serem metabolizadores pobres.
Efeito da atomoxetina nas Enzimas P450
A atomoxetina não causou inibição clinicamente importante ou indução das enzimas do citocromo P450, incluindo CYP1A2, CYP3A, CYP2D6 e CYP2C9.
Substrato do CYP3A (por exemplo, midazolam): a coadministração de atomoxetina (60 mg BID por 12 dias) com midazolam, um composto modelo para medicamentos metabolizados pelo CYP3A4 (dose única de 5 mg), resultou em um aumento de 15% na AUC11 do midazolam. Nenhum ajuste de dose é recomendado para medicamentos metabolizados pelo CYP3A.
Substrato CYP2D6 (por exemplo, Desipramina): a coadministração de atomoxetina (40 ou 60 mg BID por 13 dias) com desipramina, um composto modelo para medicamentos metabolizados pelo CYP2D6 (dose única de 50 mg), não alterou a farmacocinética da desipramina. Nenhum ajuste de dose é recomendado para medicamentos metabolizados pelo CYP2D6.
Álcool
O consumo de álcool com atomoxetina não alterou os efeitos intoxicantes do álcool.
Metilfenidato
A coadministração de metilfenidato com atomoxetina não aumentou os efeitos cardiovasculares além daqueles observados com metilfenidato sozinho.
Drogas altamente ligadas à proteína plasmática
Estudos in vitro de deslocamento de drogas foram conduzidos com atomoxetina e outras drogas altamente ligadas em concentrações terapêuticas. A atomoxetina não afetou a ligação da varfarina, ácido acetilsalicílico, fenitoína ou diazepam à albumina16 humana. Da mesma forma, esses compostos não afetaram a ligação da atomoxetina à albumina16 humana.
Drogas que afetam o pH gástrico
Os medicamentos que aumentam o pH gástrico (hidróxido de magnésio/hidróxido de alumínio, omeprazol) não tiveram efeito na biodisponibilidade de atomoxetina.
CUIDADOS COM O ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Atentah deve ser mantido em temperatura ambiente (15–30°C), protegidos da umidade e da luz
Prazo de validade: 18 meses à partir da data de fabricação. Número de lote e datas de fabricação e validade: vide embalagem
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
- Atentah 10 mg: cápsula gelatinosa dura nº 4, corpo branco, tampa branca, contendo pó branco isento de partículas estranhas.
- Atentah 18 mg: cápsula gelatinosa dura nº 4, corpo branco, tampa amarela, contendo pó branco isento de partículas estranhas.
- Atentah 25 mg: cápsula gelatinosa dura nº 4, corpo branco, tampa azul, contendo pó branco isento de partículas estranhas.
- Atentah 40 mg: cápsula gelatinosa dura nº 3, corpo azul, tampa azul, contendo pó branco isento de partículas estranhas.
- Atentah 60 mg: cápsula gelatinosa dura nº 2, corpo amarelo, tampa azul, contendo pó branco isento de partículas estranhas.
- Atentah 80 mg: cápsula gelatinosa dura nº 2, corpo branco, tampa laranja, contendo pó branco isento de partículas estranhas.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Atentah pode ser administrado com ou sem alimentos. As cápsulas devem ser tomadas inteiras com algum líquido e não devem ser abertas, divididas, trituradas, mastigadas ou dissolvidas. O tratamento com Atentah pode ser descontinuado sem redução gradativa de dose. Caso o paciente esqueça de tomar uma dose, deverá tomá-la assim que possível, não ultrapassando a dose total recomendada pelo médico para um período de 24 horas. Atomoxetina é um irritante ocular. As cápsulas de Atentah não devem ser abertas. No caso de o conteúdo da cápsula entrar em contato com os olhos99, estes devem ser enxaguados imediatamente com água e o médico deve ser consultado. As mãos100 e superfícies potencialmente contaminadas devem ser lavadas o mais rápido possível.
Tratamento Agudo7
Dose para crianças e adolescentes com até 70 kg de peso corporal:
Atentah deve ser iniciado com uma dose diária total de aproximadamente 0,5 mg/kg e aumentada após um mínimo de 3 dias para uma dose diária total alvo de aproximadamente 1,2 mg/kg administrado como uma dose única diária de manhã ou em doses uniformemente divididas de manhã e no final da tarde/início da noite. Nenhum benefício adicional foi demonstrado para doses superiores a 1,2 mg/kg/dia.
A dose diária total em crianças e adolescentes não deve exceder 1,4 mg/kg ou 100 mg, o que for menor.
Dose para crianças e adolescentes com peso corporal superior a 70 kg e adultos:
Atentah deve ser iniciado com uma dose diária total de 40 mg e aumentada após um mínimo de 3 dias para uma dose diária total alvo de aproximadamente 80 mg administrada como uma dose diária única pela manhã ou em doses igualmente divididas pela manhã e ao final da tarde/início da noite. Após 2 a 4 semanas adicionais, a dose pode ser aumentada até um máximo de 100 mg em pacientes que não alcançaram uma resposta ótima. Não há dados que apoiem o aumento da eficácia em doses mais altas.
A dose diária total máxima recomendada em crianças e adolescentes com mais de 70 kg e adultos é de 100 mg.
Tratamento prolongado/Manutenção
O tratamento farmacológico do TDAH pode ser necessário por longos períodos. O benefício de manter pacientes pediátricos (idades de 6 a 15 anos) que possuem TDAH com Atentah após atingir uma resposta em uma faixa de dose de 1,2 a 1,8 mg/kg/dia foi demonstrado em um ensaio clínico controlado. Os pacientes que utilizaram atomoxetina na fase de manutenção geralmente continuaram com a mesma dose usada para obter uma resposta na fase aberta. O médico que optar por usar Atentah por longos períodos deve reavaliar periodicamente a utilidade a longo prazo do medicamento para o paciente individual.
Dose em Populações Específicas
Uso em pacientes com insuficiência hepática46: Para os pacientes com TDAH com insuficiência hepática46 (IH), o ajuste de dose é recomendado como segue: Para pacientes76 com IH moderada (Child-Pugh Classe B), as doses iniciais e alvo devem ser reduzidas para 50% da dose normal (para pacientes76 sem IH). Para pacientes76 com IH grave (Child-Pugh Classe C), a dose inicial e as doses-alvo devem ser reduzidas para 25% do normal.
Uso com um inibidor forte do CYP2D6 ou em pacientes que são conhecidos como MPs do CYP2D6: Em crianças e adolescentes com até 70 kg de peso corporal administrados com inibidores fortes do CYP2D6, por exemplo, paroxetina, fluoxetina e quinidina, ou em pacientes conhecidos por serem CYP2D6 PMs, Atentah deve ser iniciado com 0,5 mg/kg/dia e só aumentar para a dose alvo usual de 1,2 mg/kg/dia se os sintomas5 não melhorarem após 4 semanas e a dose inicial for bem tolerada.
Em crianças e adolescentes com peso corporal acima de 70 kg e adultos que estejam utilizando inibidores potentes do CYP2D6, por exemplo, paroxetina, fluoxetina e quinidina, Atentah deve ser iniciado com 40 mg/dia e apenas aumentado para a dose alvo usual de 80 mg/dia se os sintomas5 não melhorarem após 4 semanas e a dose inicial for bem tolerada.
Uso em pacientes com insuficiência renal88: Indivíduos metabolizadores extensivos (EMs) com doença renal89 em fase terminal apresentaram exposição sistêmica à atomoxetina mais alta que indivíduos sadios (aumento de cerca de 65%), mas não houve diferença quando a exposição foi corrigida para dose em mg/kg. Portanto, Atentah pode ser administrado em pacientes com TDAH e doença renal89 em fase terminal ou insuficiência renal88 em graus menores na posologia recomendada para pacientes76 com função renal89 normal. Atentah pode exacerbar a hipertensão60 em pacientes com doença renal89 em fase terminal
Este medicamento não deve ser partido, aberto ou mastigado.
REAÇÕES ADVERSAS
A atomoxetina foi administrada a 5382 crianças ou adolescentes com TDAH e 1007 adultos com TDAH em estudos clínicos. Durante os estudos clínicos de TDAH, 1.625 crianças e adolescentes foram tratados por mais de 1 ano e 2.529 crianças e adolescentes foram tratados por mais de 6 meses.
As seguintes reações adversas relacionadas a atomoxetina foram observadas em estudos clínicos.
Reações adversas em crianças e adolescentes
|
Classificação do sistema de órgãos |
Muito comum (≥ 1/10) |
Comum (≥ 1/100 a <1/10) |
Incomum (≥1/1.000 a <1/100) |
|
Transtornos Gastrointestinais |
Dor abdominal, vômito101, náusea102 |
Constipação103 Dispepsia104 |
|
|
Transtornos Gerais e Condições de locais do Local de Administração |
|
Fadiga105 Irritabilidade Resposta terapêutica106 inesperada Dor faringolaríngea Midríase30 Astenia107 Conjuntivite108 |
Sensação de anormalidade |
|
Metabolismo10 e Transtorno Alimentares |
Diminuição do apetite |
|
|
|
Transtornos do Sistema Nervoso109 |
Cefaleia110 Sonolência Insônia |
Insônia terminal (despertar matinal) Insônia média Depressão Tremor Sedação111 Síncope59 |
Convulsóes |
|
Distúrbios de Pele112 e do Tecido Subcutâneo113 |
|
Erupções cutâneas114 Prurido53 Escoriação115 |
|
|
Transtornos Psiquiátricos |
|
Alterações de humor |
|
|
Distúrbios Cardíacos |
|
Taquicardia61 sinusal Palpitações116 |
|
|
Transtornos Vasculares35 |
|
Hipertensão60 rubor |
|
|
Investigações |
|
Perda de peso |
|
Reações adversas em adultos
|
Classificação do sistema de órgãos |
Muito comum (≥ 1/10) |
Comum (≥1/100 a <1/10) |
Incomum (≥ 1/1.000 a <1/100) |
|
Transtornos Gastrointestinais |
Boca117 seca Náusea102 cosntipação |
Dor addominal Dispesia Vômito101 Flatulência Disgeusia118 Diarreia119 |
|
|
Transtornos Gerais e Condições de locais do Local de Administração |
|
Fadiga105 Arrepios Sensação de nervosismo Irritabilidade Sede Extremidades frias Sensação de frio Astenia107 Espasmo120 muscular Dor nas costas121 Dor orofaríngea122 Visão123 turva |
Dor no peito58 |
|
Metabolismo10 e Transtorno Alimentares |
Perda de apetite |
|
|
|
Transtornos do Sistema Nervoso109 |
|
Tonturas124 Sonolência Parestesia125 Agitação Inquietação Ansiedade Cefaleia110 Nervosismo |
convulsões |
|
Distúrbios de Pele112 e do Tecido Subcutâneo113 |
Hiperidrose126 |
Prurido53 Urticária69 Rubor erupção70 |
|
|
Transtornos Psiquiátricos |
Insônia |
Sonhos anormais Diminuição da libido127 Distúrbio do sono Tremor Insônia média Insônia terminal (despertar matinal) |
Mudanças de humor Nervosismo |
|
Doenças Renais e Urinárias |
|
Hesitação urinária Disúria128 Urgência129 urinária Micção130 frequente Retenção urinária73 |
|
|
Transtornos dos órgãos reprodutivos e da mama131 |
Disfunção eretil |
Prostatite132 Dor testicular Orgasmo anormal Menstruação133 irregular Distúrbio de ejaculação134 |
Dismenorreia135 Ejaculação134 retardada |
|
Distúrbios Cardíacos |
|
Palpitações116 taquicardias |
|
|
Transtornos Vasculares35 |
|
Ondas de calor |
|
|
Investigações |
|
Perda de peso |
|
Experiência Pós-Comercialização
As seguintes reações adversas foram relatadas durante a experiência pós-comercialização com atomoxetina. A menos que especificado de outra forma, essas reações adversas ocorreram em adultos, crianças e adolescentes. Como estas reações são notificadas a partir de uma população de dimensão incerta, nem sempre é possível estimar de forma confiável a sua frequência ou estabelecer uma relação causal com a exposição ao medicamento.
- Sistema cardiovascular98: prolongamento do intervalo QT, síncope59.
- Efeitos vasculares35 periféricos: fenômeno de Raynaud136.
- Transtornos Gerais e Condições do Local de Administração: letargia137
- Sistema musculoesquelético: rabdomiólise138.
- Doenças do sistema nervoso109: hipoestesia139, parestesia125 em crianças e adolescentes; distúrbios sensoriais, tiques.
- Transtornos psiquiátricos: depressão e humor deprimido, ansiedade, alterações da libido127.
- Convulsões: foram relatadas convulsões no período pós-comercialização. Os casos de convulsão140 pós- comercialização incluem pacientes com distúrbios convulsivos pré-existentes e aqueles com fatores de risco identificados para convulsões, bem como pacientes sem histórico nem fatores de risco identificados para convulsões. A relação exata entre atomoxetina e convulsões é difícil de avaliar devido à incerteza sobre o risco de histórico de convulsões em pacientes com TDAH.
- Distúrbios do tecido141 cutâneo142 e subcutâneo143: alopecia144, hiperidrose126.
- Sistema urogenital145: dor pélvica146 masculina, hesitação urinária em crianças e adolescentes, retenção urinária73 em crianças e adolescentes.
Atenção: este produto é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
A experiência em estudos clínicos com sobredosagem de atomoxetina é limitada. Durante a pós- comercialização, foram relatadas fatalidades envolvendo uma sobredosagem por ingestão mista de atomoxetina e pelo menos um outro medicamento. Não houve relatos de morte envolvendo sobredosagem apenas com atomoxetina, incluindo sobredosagens intencionais de até 1400 mg. Em alguns casos de sobredosagem envolvendo atomoxetina, foram relatadas convulsões. Os sintomas5 mais comumente relatados que acompanham as sobredosagens agudas e crônicas de atomoxetina foram sintomas5 gastrointestinais, sonolência, tonturas124, tremores e comportamento anormal. Hiperatividade e agitação também foram relatadas. Também foram observados sinais4 e sintomas5 consistentes com ativação do sistema nervoso109 simpático147 leve a moderada (por exemplo, taquicardia61, aumento da pressão arterial32, midríase30, boca117 seca). A maioria dos eventos foram leves a moderados. Menos comumente, há relatos de prolongamento do intervalo QT e alterações mentais, incluindo desorientação e alucinações66.
Tratamento
Não existe tratamento específico para superdose com Atentah. O tratamento tem sido de suporte, incluindo o estabelecimento de uma via aérea quando necessário, monitoramento de sinais vitais25 e cardíacos, juntamente com medidas sintomáticas e de suporte apropriadas. A lavagem gástrica148 pode ser indicada se realizada logo após a ingestão. O carvão ativado pode ser útil para limitar a absorção. Como a atomoxetina é altamente ligada às proteínas15, a diálise149 provavelmente não será útil no tratamento de superdose.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
ATENÇÃO: PODE CAUSAR DEPENDÊNCIA FÍSICA OU PSÍQUICA
Registro: 1.0118.0649
Responsável Técnico: Rodrigo de Morais Vaz CRF-SP nº 39.282
Registrado e produzido por:
APSEN FARMACÊUTICA S/A
Rua La Paz, nº 37/67 – Santo Amaro CEP 04755-020 – São Paulo – SP
CNPJ 62.462.015/0001-29
Indústria Brasileira
SAC 0800 016 5678