Onicit (Bula do profissional de saúde)
SCHERING-PLOUGH INDÚSTRIA FARMACÊUTICA LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Onicit
cloridrato de palonosetrona
Injetável 0,05 mg/mL
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Solução injetável
Frasco-ampola de 1,5 mL ou 5 mL
USO INTRAVENOSO
USO ADULTO E PEDIÁTRICO ACIMA DE 1 MÊS DE IDADE
COMPOSIÇÃO:
Cada frasco-ampola de Onicit 1,5 mL contém:
| palonosetrona (na forma de cloridrato) | 0,075 mg |
| veículo q.s.p. | 1,5 mL |
Veículo: manitol, edetato dissódico e tampão citrato em água para injetáveis. O pH dessa solução é de 4,5 a 5,5.
Cada frasco-ampola de Onicit 5 mL contém:
| palonosetrona (na forma de cloridrato) | 0,25 mg |
| veículo q.s.p. | 5 mL |
Veículo: manitol, edetato dissódico e tampão citrato em água para injetáveis. O pH dessa solução é de 4,5 a 5,5.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE1
INDICAÇÕES
Onicit é indicado a adultos para:
- na prevenção de náuseas2 e vômitos3 agudos associados aos ciclos inicial e de repetição da quimioterapia4 moderadamente e altamente emetogênica contra o câncer5, e
- na prevenção de náuseas2 e vômitos3 tardios associados aos ciclos inicial e de repetição da quimioterapia4 moderadamente emetogênica contra o câncer5.
- Náuseas2 e vômitos3 induzidos por quimioterapia4
- Náuseas2 e vômitos3 no pós-operatório
- Na prevenção de náuseas2 e vômitos3 no pós-operatório (NVPO), por até 24 horas após a cirurgia.
Onicit é indicado para pacientes6 pediátricos, a partir de 1 mês até os 17 anos de idade, para:
- Náuseas2 e vômitos3 induzidos por quimioterapia4
- Prevenção de náuseas2 e vômitos3 agudos associados aos ciclos inicial e de repetição da quimioterapia4 emetogênica contra o câncer5, incluindo a altamente emetogênica.
RESULTADOS DE EFICÁCIA
Náuseas2 e vômitos3 induzidos por quimioterapia4
A eficácia de uma injeção7 em dose única de palonosetrona na prevenção de náuseas2 e vômitos3 agudos e tardios induzidos por quimioterapia4 tanto moderada quanto altamente emetogênica, foi estudada em três estudos clínicos de Fase 3 e um estudo clínico de Fase 2. Nesses estudos duplos-cegos, os índices de resposta completa (sem episódios eméticos e sem medicação de resgate) e outros parâmetros de eficácia foram avaliados durante pelo menos 120 horas após a administração da quimioterapia4. A segurança e a eficácia da palonosetrona em cursos repetidos de quimioterapia4 também foram estudadas.
Quimioterapia4 moderadamente emetogênica
Dois estudos clínicos de Fase 3, duplos-cegos envolvendo 1.132 pacientes, compararam a dose única IV de Onicit ou com a dose única IV de ondansetrona (estudo 1), ou com a dolasetrona (estudo 2), administradas 30 minutos antes de quimioterapia4 moderadamente emetogênica que incluía carboplatina, cisplatina ≤ 50 mg/m2, ciclofosfamida < 1.500 mg/m2, doxorrubicina > 25 mg/m2, epirrubicina, irinotecano e metotrexato > 250 mg/m2. Corticosteroides concomitantes não foram administrados profilaticamente no estudo 1, e foram usados por apenas 4% a 6% dos pacientes no estudo 2. A maioria dos pacientes nesses estudos era mulheres (77%), brancos (65%) e sem quimioterapia4 anterior (54%). A média de idade era de 55 anos.
Quimioterapia4 altamente emetogênica
Um estudo de Fase 2, duplo-cego e de doses variadas avaliou a eficácia da dose única IV de palonosetrona de 0,3 a 90 mcg/kg (equivalente a < 0,1 mg a 6 mg de dose fixa) em 161 pacientes adultos com câncer5 que nunca haviam sido tratados com quimioterapia4 e receberam quimioterapia4 altamente emetogênica (cisplatina ≥ 70 mg/m2 ou ciclofosfamida > 1.100 mg/m2). Corticosteroides concomitantes não foram administrados profilaticamente. A análise de dados desse estudo indica que 0,25 mg é a menor dose eficaz na prevenção de náuseas2 e vômitos3 agudos induzidos por quimioterapia4 altamente emetogênica.
Um estudo clínico de Fase 3, duplo-cego, envolvendo 667 pacientes comparou a dose única IV de Onicit com a dose única IV de ondansetrona (estudo 3) administrada 30 minutos antes de quimioterapia4 altamente emetogênica que incluiu cisplatina ≥ 60 mg/m2, ciclofosfamida > 1.500 mg/m2 e dacarbazina. Corticosteroides foram coadministrados profilaticamente antes da quimioterapia4 em 67% dos pacientes. Dos 667 pacientes, 51% eram mulheres, 60% brancos e 59% nunca haviam sido tratados com quimioterapia4. A média de idade era de 52 anos.
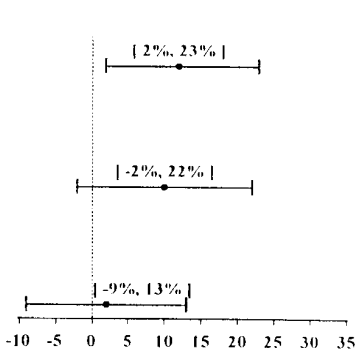
A atividade antiemética de Onicit foi avaliada durante a fase aguda (0-24 horas,Tabela 1), a fase tardia (24-120 horas,Tabela 2) e a fase total (0-120 horas,Tabela 3) pós-quimioterapia4 em estudos clínicos Fase 3.
Tabela 1: Prevenção de náuseas2 e vômitos3 agudos (0-24 horas): índices de resposta completa
|
Quimioterapia4 |
Estudo |
Grupo de tratamento |
Na |
% com resposta completa |
Valor de pb |
Intervalo de confiança de 97,5% Onicit menos o comparativoc
 Diferença nos índices de resposta completa |
|
Moderadamente emetogênica |
1 |
Onicit |
189 |
81 |
0,009 |
|
|
ondansetrona |
185 |
69 |
||||
|
2 |
Onicit |
189 |
63 |
NS |
||
|
dolasetrona |
191 |
53 |
||||
|
Altamente emetogênica |
3 |
Onicit |
223 |
59 |
NS |
|
|
ondansetrona |
221 |
57 |
a Corte de intenção de tratamento
b Teste exato de Fisher bilateral. Nível de significância em α = 0,025.
c Os estudos foram desenhados para revelar a não-inferioridade. Um limite inferior maior que –15% demonstra não-inferioridade entre Onicit e o comparativo.
Esses estudos mostram que Onicit foi eficaz na prevenção de náuseas2 e vômitos3 agudos associados aos ciclos iniciais e de repetição de quimioterapia4 moderada a altamente emetogênica contra o câncer5. No estudo 3, a eficácia foi maior quando corticosteroides profiláticos foram administrados concomitantemente. A superioridade clínica sobre outros antagonistas do receptor 5-HT3 não foi adequadamente demonstrada na fase aguda.
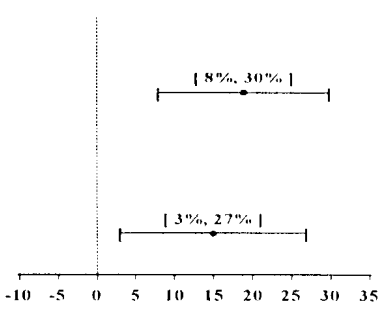
Tabela 2: Prevenção de náuseas2 e vômitos3 tardios (24-120 horas): índices de resposta completa
|
Quimioterapia4 |
Estudo |
Grupo de tratamento |
Na |
% com resposta completa |
Valor de pb |
Intervalo de confiança de 97,5% Onicit menos o comparativoc
 Diferença nos índices de resposta completa |
|
Moderadamente emetogênica |
1 |
Onicit |
189 |
74 |
<0,001 |
|
|
ondansetrona |
185 |
55 |
||||
|
2 |
Onicit |
189 |
54 |
0,004 |
||
|
dolasetrona |
191 |
39 |
a Corte de intenção de tratamento
b Teste exato de Fisher bilateral. Nível de significância em α = 0,025.
c Os estudos foram desenhados para revelar a não-inferioridade. Um limite inferior maior que –15% demonstra não-inferioridade entre Onicit e o comparativo.
Esses estudos mostram que Onicit foi eficaz na prevenção de náuseas2 e vômitos3 tardios associados aos ciclos iniciais e de repetição da quimioterapia4 moderadamente emetogênica.
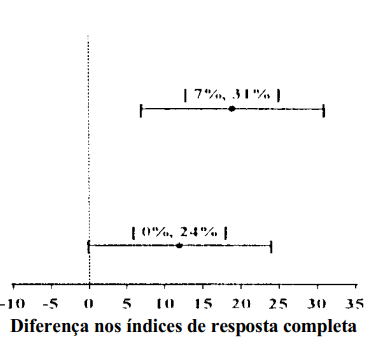
Tabela 3: Prevenção de náuseas2 e vômitos3 globais (0-120 horas): índices de resposta completa
|
Quimioterapia4 |
Estudo |
Grupo de tratamento |
Na |
% com resposta completa |
Valor de pb |
Intervalo de confiança de 97,5% Onicit menos o comparativoc
 Diferença nos índices de resposta completa |
|
Moderadamente emetogênica |
1 |
Onicit |
189 |
69 |
<0,001 |
|
|
ondansetrona |
185 |
50 |
||||
|
2 |
Onicit |
189 |
46 |
0,021 |
||
|
dolasetrona |
191 |
34 |
a Corte de intenção de tratamento
b Teste exato de Fisher bilateral. Nível de significância em α = 0,025.
c Os estudos foram desenhados para revelar a não-inferioridade. Um limite inferior maior que –15% demonstra não-inferioridade entre Onicit e o comparativo.
Esses estudos mostram que Onicit foi eficaz na prevenção de náuseas2 e vômitos3 durante todo o período de 120 horas (5 dias) após os ciclos inicial e de repetição de quimioterapia4 moderadamente emetogênica contra o câncer5.
Náuseas2 e vômitos3 no pós-operatório
Em um estudo clínico multicêntrico, randomizado8, estratificado, duplo-cego, de grupos paralelos e de Fase 3 (estudo 1), a palonosetrona foi comparada ao placebo9 na prevenção de NVPO em 546 pacientes que se submeteram a cirurgias abdominal e ginecológica. Todos os pacientes receberam anestesia10 geral. O estudo 1 foi pivotal e conduzido predominantemente nos Estados Unidos em um grupo de pacientes selecionados entre os eletivos11 para a cirurgia ginecológica ou a laparoscopia12 abdominal e a randomização foi estratificada para os seguintes fatores de risco: gênero, não fumante, histórico de náuseas2 e vômitos3 no pós-operatório e/ou por movimento.
No estudo 1, os pacientes foram randomizados para receber palonosetrona 0,025 mg, 0,050 mg,0,075 mg ou placebo9, administrados por via intravenosa imediatamente antes da indução da anestesia10. A atividade antiemética da palonosetrona foi avaliada pelo período de 0 a 72 horas após a cirurgia.
Dos 138 pacientes tratados com 0,075 mg de palonosetrona no estudo 1 e avaliados para eficácia, 96% eram mulheres, 66% tinham histórico de náuseas2 e vômitos3 no pós-operatório e/ou por movimento, 85% eram não fumantes. Na avaliação por etnia, 63% eram brancos, 20% eram negros, 15% eram hispânicos e 1% era asiático. A idade dos pacientes variou entre 21 e 74 anos, com uma média de idade de 37,9 anos. Três pacientes tinham mais de 65 anos de idade.
A medida da coeficácia primária foi a resposta completa (RC), definida como nenhum episódio emético e não utilização de medicamentos de resgate em 0 a 24 horas e 24 a 72 horas após a cirurgia.
O desfecho da eficácia secundário incluiu:
- Resposta completa (RC) em 0 a 48 e 0 a 72 horas;
- Controle completo (CC), definido como RC e não mais que uma náusea13 leve;
- Gravidade das náuseas2 (nenhuma, leve, moderada e grave).
A hipótese primária no estudo 1 foi a de que pelo menos uma das três doses de palonosetrona seria superior à do placebo9.
Os resultados para resposta completa no estudo 1 para 0,075 mg de palonosetrona versus o placebo9 estão descritos na tabela a seguir:
Tabela 4: Prevenção das náuseas2 e vômitos3 no pós-operatório; resposta completa (RC), estudo 1, 0,075 mg de palonosetrona versus placebo9
|
Tratamento |
n/N (%) |
palonosetrona vs placebo9 |
|
|
Variação |
Valor de p* |
||
|
Co-desfecho primário |
|||
|
RC em 0 a 24 horas |
|||
|
Palonosetrona |
59/138 (42,8%) |
16,8% |
0,004 |
|
Placebo9 |
35/135 (25,9%) |
|
|
|
RC em 24 a 72 horas |
|||
|
Palonosetrona |
67/138 (48,6%) |
7,8% |
0,188 |
|
Placebo9 |
55/135 (40,7%) |
|
|
* Para alcançar significância estatística para cada co-desfecho primário, o limite de significância requerido para o menor valor de p foi de p < 0,017.
Variação da diferença (%): 0,075 mg de palonosetrona menos placebo9.
A dose de 0,075 mg de palonosetrona reduziu a gravidade das náuseas2 quando comparada com o placebo9. A análise de outro desfecho secundário indicou que 0,075 mg de palonosetrona foi numericamente melhor que o placebo9, entretanto, a significância estatística não foi formalmente demonstrada.
Um estudo randomizado14 de Fase 2, duplo-cego, multicêntrico, controlado por placebo9 de variação de dose foi realizado para avaliar a palonosetrona intravenosa na prevenção de náuseas2 e vômitos3 no pós- operatório de cirurgia abdominal ou de histerectomia15 vaginal. Cinco doses de palonosetrona IV (0,1 mcg/kg, 0,3 mcg/kg, 1,0 mcg/kg, 3,0 mcg/kg e 30 mcg/kg) foram avaliadas em um total de 381 pacientes com intenção de tratar. A medida de eficácia primária foi a proporção de pacientes com resposta completa nas primeiras 24 horas após a recuperação da cirurgia. A menor dose efetiva foi de 1 mcg/kg de palonosetrona (aproximadamente 0,075 mg), a qual propiciou uma taxa de resposta completa de 44% versus 19% para o placebo9, p = 0,004. A dose de 1 mcg/kg de palonosetrona também reduziu significantemente a gravidade das náuseas2 versus placebo9, p = 0,009.
População pediátrica
Prevenção de náuseas2 e vômitos3 induzidos por quimioterapia4 (NVIQ):
A segurança e a eficácia de palonosetrona IV, em doses únicas de 3 μg/kg e 10 μg/kg, foram investigadas no primeiro estudo clínico em 72 pacientes nas seguintes faixas etárias: > 28 dias a 23 meses (12 pacientes), 2 a 11 anos (31 pacientes) e 12 a 17 anos de idade (29 pacientes), que receberam quimioterapia4 altamente ou moderadamente emetogênica. Nenhum desses níveis de dosagem despertou preocupações relativas a segurança. A variável primária de eficácia foi a proporção de pacientes com resposta completa (RC, definida como a ausência de episódios eméticos e de uso de medicação de resgate) durante as primeiras 24 horas após o início da administração da quimioterapia4. A eficácia após palonosetrona 10 μg/kg em comparação com palonosetrona 3 μg/kg foi de 54,1% e 37,1%, respectivamente.
A eficácia de Onicit na prevenção de náuseas2 e vômitos3 induzidos por quimioterapia4 em pacientes pediátricos com câncer5 foi demonstrada em um segundo ensaio pivotal de não inferioridade, que comparou uma infusão intravenosa única de palonosetrona versus um regime IV com ondansetrona. Um total de 493 pacientes pediátricos com idades entre 64 dias e 16,9 anos, recebendo quimioterapia4 com ação altamente ou moderadamente emetogênica, foram tratados com palonosetrona 10 μg/kg (máximo de 0,75 mg), palonosetrona 20 μg/kg (máximo de 1,5 mg) ou ondansetrona (3 x 0,15 mg/kg, dose máxima total de 32 mg), 30 minutos antes do início da quimioterapia4 emetogênica, durante o ciclo 1. A maior parte dos pacientes, em todos os grupos de tratamento, já havia sido tratada anteriormente com quimioterapia4 (78,5%). As quimioterapias emetogênicas administradas incluíram doxorrubicina, ciclofosfamida (< 1.500 mg/m2), ifosfamida, cisplatina, dactinomicina, carboplatina e daunorrubicina. Foram administrados corticosteroides adjuvantes, incluindo dexametasona, com a quimioterapia4 em 55% dos pacientes. O desfecho primário da eficácia foi a resposta completa na fase aguda do primeiro ciclo de quimioterapia4, definida como ausência de vômitos3, de náuseas2 e de uso de medicação de resgate, nas primeiras 24 horas após o início da quimioterapia4. A eficácia baseou-se na demonstração de não inferioridade de palonosetrona intravenosa em comparação com ondansetrona intravenosa. Os critérios de não inferioridade eram atingidos se o limite inferior do intervalo de confiança de 97,5% para a diferença nas taxas de resposta completa de palonosetrona intravenosa menos ondansetrona intravenosa fosse maior do que -15%. A taxa de resposta de palonosetrona intravenosa menos ondansetrona intravenosa foi maior do que -15%. Nos grupos de palonosetrona 10 μg/kg, 20 μg/kg e ondansetrona, a proporção de pacientes com RC0-24h foi de 54,2%, 59,4% e 58,6%, respectivamente. Como o intervalo de confiança de 97,5% (teste de Mantel-Haenszel ajustado em termos de estrato) da diferença na RC0-24h entre palonosetrona 20 μg/kg e ondansetrona foi de [-11,7% e 12,4%], a dose de 20 μg/kg de palonosetrona demonstrou não inferioridade em relação à da ondansetrona.
Embora esse estudo tenha demonstrado que pacientes pediátricos requerem uma dose de palonosetrona superior à dos adultos para prevenir náuseas2 e vômitos3 induzidos por quimioterapia4, o perfil de segurança é consistente com o perfil estabelecido em adultos.
Prevenção de náuseas2 e vômitos3 no pós-operatório (NVPO):
Foram conduzidos dois estudos pediátricos. A segurança e a eficácia de palonosetrona IV, em doses únicas de 1 μg/kg e 3 μg/kg, foi comparada no primeiro estudo clínico em 150 pacientes nas seguintes faixas etárias: > 28 dias a 23 meses (7 pacientes), 2 a 11 anos (96 pacientes) e 12 a 16 anos de idade (47 pacientes) submetidos a cirurgia eletiva16. Não foram levantadas questões de segurança nesses grupos de tratamento. A proporção de pacientes sem êmese17 durante 0-72 horas do pós-operatório foi semelhante após palonosetrona 1 μg/kg e 3 μg/kg (88% versus 84%).
O segundo estudo clínico pediátrico foi multicêntrico, duplo-cego e com dupla simulação, randomizado8, de grupos paralelos com controle ativo, de dose única e de não inferioridade, e comparou palonosetrona IV (1 μg/kg, máx 0,075 mg) versus ondansetrona IV. Participaram dele 670 pacientes pediátricos submetidos a cirurgia, com idades entre 30 dias e 16,9 anos. O desfecho primário de eficácia, resposta completa (RC: ausência de vômitos3, de náusea13 e de uso de medicação antiemética de resgate) durante as primeiras 24 horas do pós-operatório, foi atingido em 78,2% dos pacientes no grupo de palonosetrona e em 82,7% no grupo de ondansetrona. Dada a margem de não inferioridade pré-especificada de -10%, o intervalo de confiança estatístico de não inferioridade de Mantel-Haenszel ajustado em termos de estrato para a diferença no desfecho primário, a resposta completa (RC), foi de [-10,5 e 1,7%], portanto, a não inferioridade não foi demonstrada. Esses grupos de tratamento não despertaram novas preocupações relativas à segurança.
CARACTERÍSTICAS FARMACOLÓGICAS
AÇÕES
O cloridrato de palonosetrona é um agente antiemético18 e antinauseante. É um antagonista19 seletivo do receptor subtipo 3 da serotonina (5-HT3) com uma alta afinidade de ligação por esse receptor.
FARMACOLOGIA20 CLÍNICA
Propriedades físicas e químicas
O cloridrato de palonosetrona é um pó cristalino21 de branco a esbranquiçado. É facilmente solúvel em água, solúvel em propilenoglicol e ligeiramente solúvel em etanol e 2 -propanol.
Quimicamente, o cloridrato de palonosetrona é: cloridrato de (3aS)-2-[(S)-1-azabiciclo[2.2.2]oct-3-il]- 2,3,3a,4,5,6-hexaidro-1-oxo-1Hbenz[de] isoquinolina. A fórmula empírica é C19H24N2O•HCl, com um peso molecular de 332,87 g/mol. O cloridrato de palonosetrona existe como um isômero único.
Farmacodinâmica
A palonosetrona é um antagonista19 seletivo do receptor 5-HT3 (serotonina subtipo 3) com uma alta afinidade de ligação por esse receptor e pouca ou nenhuma afinidade por outros receptores. A palonosetrona difere dos outros setrons de primeira geração existentes no mercado por apresentar uma alta afinidade de ligação ao receptor e um prolongamento importante da meia-vida plasmática.
A quimioterapia4 para tratamento do câncer5 pode estar associada a uma elevada incidência22 de náuseas2 e vômitos3, particularmente quando são utilizados determinados agentes, como a cisplatina. Os receptores 5- HT3 estão localizados nos terminais do nervo vago na periferia e centralmente na zona do gatilho do quimiorreceptor da área postrema23. Acredita-se que os agentes quimioterápicos produzam náuseas2 e vômitos3 por meio da liberação de serotonina das células enterocromafins24 do intestino delgado25, e que a serotonina liberada então ative os receptores 5-HT3 localizados nos aferentes vagais para iniciar o reflexo de vômito26.
As náuseas2 e os vômitos3 no pós-operatório são influenciados por múltiplos fatores relacionados ao paciente, a cirurgia e a anestesia10. São desencadeados pela liberação de 5-HT3 em uma cascata de eventos neuronais envolvendo o sistema nervoso central27 e o trato gastrintestinal. O receptor 5-HT3 demonstrou participar seletivamente na resposta emética.
Os efeitos da palonosetrona sobre a pressão arterial28, a frequência cardíaca e os parâmetros eletrocardiográficos, inclusive QTc, foram comparáveis aos da ondansetrona e da dolasetrona em estudos clínicos para náuseas2 e vômitos3 induzidos por quimioterapia4 (NVIQ). Nos estudos clínicos para náuseas2 e vômitos3 no pós-operatório (NVPO), os efeitos da palonosetrona sobre o intervalo QTc não foram diferentes dos do placebo9. Em estudos não-clínicos, a palonosetrona possui a habilidade de bloquear canais de íons29 envolvidos na despolarização e repolarização ventricular e de prolongar a duração do potencial de ação.
O efeito da palonosetrona no intervalo QTc foi avaliado em um estudo clínico duplo-cego, randomizado8, paralelo, controlado por placebo9 e positivo (moxifloxacino) em homens e mulheres adultos. O objetivo foi avaliar os efeitos no eletrocardiograma30 (ECG) da administração IV de palonosetrona em doses únicas de 0,25 mg, 0,75 mg ou 2,25 mg em 221 indivíduos sadios. O estudo demonstrou que não há efeito em qualquer intervalo do ECG incluindo a duração do intervalo QTc (repolarização cardíaca) em doses de até 2,25 mg.
Farmacocinética
Após administração intravenosa de palonosetrona em indivíduos saudáveis e pacientes com câncer5, um declínio inicial nas concentrações plasmáticas foi seguido por uma lenta eliminação do corpo. A concentração plasmática máxima (Cmáx) média e a área sob a curva de concentração-tempo (AUC310-∞) são geralmente proporcionais à dose na faixa de 0,3 a 90 mcg/kg em indivíduos saudáveis e em pacientes com câncer5. Após dose intravenosa (IV) única de palonosetrona de 3 mcg/kg (ou 0,21 mg/70 kg) em seis pacientes com câncer5, estimou-se que a concentração plasmática máxima média (±DP) fosse de 5,6 ± 5,5 ng/mL e a AUC31 média de 35,8 ± 20,9 h·mcg/L.
Após dose intravenosa de palonosetrona em pacientes que passaram por cirurgias abdominal ou de histerectomia15 vaginal, as características farmacocinéticas da palonosetrona foram similares àquelas observadas em pacientes com câncer5.
Distribuição: a palonosetrona tem um volume de distribuição de aproximadamente 8,3 ± 2,5 L/kg. Aproximadamente 62% da palonosetrona está ligada a proteínas32 plasmáticas.
Metabolismo33: a palonosetrona é eliminada por várias vias, sendo aproximadamente 50% convertido em dois metabólitos34 principais: N-óxido-palonosetrona e 6-S-hidroxi-palonosetrona. Cada um desses metabólitos34 tem menos de 1% da atividade antagonista19 do receptor 5-HT3 da palonosetrona. Estudos de metabolismo33 in vitro sugeriram que a CYP2D6 e, em menor grau, a CYP3A e a CYP1A2 estão envolvidas no metabolismo33 da palonosetrona. Entretanto, os parâmetros farmacocinéticos clínicos não são significativamente diferentes entre os metabolizadores fracos e os intensos de substratos da CYP2D6.
Eliminação: depois de uma dose intravenosa única de 10 mcg/kg [C14]-palonosetrona, aproximadamente 80% da dose foi recuperada nas primeiras 144 horas na urina35, sendo que a palonosetrona representava aproximadamente 40% da dose administrada. Em indivíduos saudáveis, a depuração corpórea total de palonosetrona foi de 160 ± 35 mL/h/kg, e a depuração renal36 foi de 66,5 ± 18,2 mL/h/kg. A meia-vida de eliminação terminal média é de aproximadamente 40 horas.
Farmacocinética em populações especiais
População pediátrica
Foram obtidos dados farmacocinéticos com uma dose única de Onicit IV a partir de um subconjunto de pacientes pediátricos com câncer5 que receberam 10 μg/kg ou 20 μg/kg. Quando a dose foi aumentada de 10 μg/kg para 20 μg/kg, observou-se um aumento proporcional à dose da AUC31 média. Após a infusão intravenosa de uma dose única de 20 μg/kg de Onicit, as concentrações plasmáticas máximas (CT) relatadas ao final da infusão de 15 minutos foram altamente variáveis em todas as faixas etárias e observou-se uma tendência a serem inferiores em pacientes com < 6 anos de idade, em relação a pacientes mais velhos. A meia-vida mediana foi de 29,5 horas nas faixas etárias em geral e variou cerca de 20 a 30 horas em todas as faixas etárias, após a administração de 20 μg/kg. A depuração corporal total (L/h/kg) em pacientes com 12 a 17 anos de idade foi similar à que se observou em adultos saudáveis. Não há diferenças aparentes no volume de distribuição quando expresso em L/kg.
Tabela 5: Parâmetros farmacocinéticos em pacientes pediátricos com câncer5 após a perfusão intravenosa de Onicit 20 μg/kg durante 15 min, e em pacientes adultos com câncer5 recebendo doses de palonosetrona de 3 e 10 μg/kg em bolo intravenoso.
|
Parâmetro farmacocinéticoa |
Pacientes pediátricos com câncer5a |
Pacientes adultos com câncer5b |
||||
|
|
< 2 anos |
2 a < 6 anos |
6 a < 12 anos |
12 a < 17 anos |
3,0 μg/kg |
10 μg/kg |
|
|
N = 3 |
N = 5 |
N = 7 |
N = 10 |
N = 6 |
N = 5 |
|
AUC310-∞, h·μg/L |
69,0 |
103,5 |
98,7 |
124,5 |
35,8 |
81,8 |
|
t½, horas |
24,0 |
28 |
23,3 |
30,5 |
56,4 |
49,8 |
|
|
N = 6 |
N = 14 |
N = 13 |
N = 19 |
N = 6 |
N = 5 |
|
Depuraçãoc, L/h/kg |
0,31 |
0,23 |
0,19 |
0,16 |
0,10 |
0,13 |
|
Vssd, L/kg |
6,08 |
5,29 |
6,26 |
6,20 |
7,91 |
9,56 |
a Parâmetros farmacocinéticos expressos em média geométrica (CV), exceto para t1/2, que é apresentada como mediana.
b Parâmetros farmacocinéticos expressos em média aritmética (DP).
c A depuração e o volume de distribuição em pacientes pediátricos foram calculados com ajuste do peso para os grupos com doses de 10 μg/kg e 20 μg/kg combinados. Em adultos, são indicados níveis de dose diferentes na coluna do título.
d O Vss é relatado para os pacientes pediátricos com câncer5, enquanto o Vz é relatado para os pacientes adultos com câncer5.
TOXICOLOGIA PRÉ-CLÍNICA:
Carcinogênese, mutagênese, comprometimento da fertilidade
Em um estudo de carcinogenicidade de 104 semanas em camundongos CD-1, os animais foram tratados com doses orais de palonosetrona de 10, 30 e 60 mg/kg/dia. O tratamento com palonosetrona não foi tumorigênico. A maior dose testada produziu uma exposição sistêmica à palonosetrona (AUC31 plasmática) de cerca de 150 a 289 vezes a exposição humana (AUC31 = 29,8 h·mcg/L) na dose intravenosa recomendada de 0,25 mg. Em um estudo de carcinogenicidade de 104 semanas em ratos Sprague-Dawley, ratos machos e fêmeas foram tratados com doses orais de 15, 30 e 60 mg/kg/dia e de 15, 45 e 90 mg/kg/dia, respectivamente. As maiores doses produziram uma exposição sistêmica à palonosetrona (AUC31 plasmática) de 137 e 308 vezes a exposição humana na dose recomendada. O tratamento com palonosetrona produziu incidências aumentadas de feocromocitoma37 benigno adrenal e feocromocitoma37 benigno e maligno associados, incidências aumentadas de adenoma38 e de combinação de adenoma38 e carcinoma39 de células40 de ilhota pancreática, e adenoma38 hipofisário em ratos machos. Nas ratas, produziu adenoma38 e carcinoma39 hepatocelular e incidências aumentadas de adenoma38, e de combinação de adenoma38 e carcinoma39 de células40 C de tireoide41.
A palonosetrona não foi genotóxica no teste de Ames, no teste de mutação42 anterógrada com células40 de ovário43 de hamster chinês (CHO/HGPRT), no teste de síntese não programada de DNA (UDS) em hepatócito ex vivo ou no teste de micronúcleo de camundongo. Foi, contudo, positivo para efeitos clastogênicos no teste de aberração cromossômica em célula44 de ovário43 de hamster chinês (CHO).
Foi constatado que a palonosetrona em doses orais de até 60 mg/kg/dia (aproximadamente 1.894 vezes a dose intravenosa humana recomendada, com base em área de superfície corporal) não apresenta nenhum efeito sobre a fertilidade e o desempenho reprodutivo de ratos machos e fêmeas.
CONTRAINDICAÇÕES
Onicité contraindicado para uso por pacientes com hipersensibilidade conhecida ao princípio ativo ou a qualquer um de seus componentes.
ADVERTÊNCIAS E PRECAUÇÕES
Geral
Podem ocorrer reações de hipersensibilidade em pacientes que apresentaram hipersensibilidade a outros antagonistas seletivos do receptor 5-HT3.
Como a palonosetrona pode aumentar o tempo de trânsito colônico, pacientes com histórico de constipação45 ou sinais46 de obstrução intestinal subaguda47 devem ser monitorados após a administração.
Em todas as doses testadas, a palonosetrona não induziu um prolongamento clinicamente relevante do intervalo QTc, como demonstrado em um estudo minucioso e específico do intervalo QT/QTc, conduzido em pacientes saudáveis [veja 3. CARACTERÍSTICAS FARMACOLÓGICAS]. Entretanto, como para outros antagonistas de 5-HT3, deve-se ter cuidado na administração concomitante de palonosetrona com medicamentos que aumentem o intervalo QT ou em pacientes que tem ou são susceptíveis ao desenvolvimento do prolongamento do intervalo QT.
Onicit não deve ser utilizado para previnir ou tratar náusea13 e vômito26 nos dias seguintes à quimioterapia4 se não estiver associado a outra administração de quimioterapia4.
Houve relatos de síndrome serotoninérgica48 com o uso de antagonistas de 5-HT3 isolados ou em associação com outros medicamentos serotoninérgicos, incluindo inibidores seletivos da recaptação de serotonina (ISRSs) e inibidores da recaptação de serotonina e noradrenalina49 (ISRSNs).
Efeitos na habilidade de dirigir e operar máquinas
Não foram observados efeitos sobre a habilidade de dirigir veículos e operar máquinas. Como a palonosetrona pode causar tonturas50, sonolência ou fadiga51, pacientes devem ser alertados quando forem dirigir ou operar máquinas
Gravidez52, Lactação53 e efeitos teratogênicos54
Veja o item 8. posologia e modo de usar - posologia
Categoria B.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Foram realizados estudos teratogênicos54 em ratos com doses orais de até 60 mg/kg/dia (1.894 vezes a dose intravenosa humana recomendada baseada em área de superfície corporal) e em coelhos com doses orais de até 60 mg/kg/dia (3.789 vezes a dose intravenosa humana recomendada baseada em área de superfície corporal). Esses estudos não revelaram evidências de fertilidade comprometida nem de dano ao feto55 por causa da palonosetrona. Entretanto, não existem estudos adequados e bem-controlados em mulheres gestantes.
Uma vez que os estudos de reprodução56 em animais nem sempre são preditivos da resposta humana, a palonosetrona só deverá ser usada durante a gravidez52 se evidentemente necessário.
Não se sabe se a palonosetrona é excretada no leite humano. Uma vez que muitos fármacos são excretados no leite humano, e por causa do potencial de reações adversas sérias nos bebês57 lactentes58 e do potencial de tumorigenicidade demonstrado para a palonosetrona no estudo de carcinogenicidade em ratos, deve-se decidir quanto à suspensão da amamentação59 ou da medicação, levando em consideração a importância do medicamento para a mãe.
INTERAÇÕES MEDICAMENTOSAS
A palonosetrona é eliminada do corpo através da excreção renal36 e das vias metabólicas, com as últimas mediadas por várias enzimas CYP. Estudos in vitro adicionais indicaram que a palonosetrona não é uma inibidora das CYP1A2, CYP2A6, CYP2B6, CYP2C9, CYP2D6, CYP2E1 e CYP3A4/5 (a CYP2C19 não foi investigada), e não induz a atividade das CYP1A2, CYP2D6 ou CYP3A4/5. Portanto, o potencial para interações medicamentosas clinicamente significativas com a palonosetrona parece ser baixo.
A administração concomitante de 0,25 mg de palonosetrona IV e 20 mg de dexametasona IV em indivíduos sadios foi segura e bem tolerada. Nesse estudo não houve interação farmacocinética entre a palonosetrona e a dexametasona.
Em um estudo de interação em indivíduos sadios em que 0,25 mg de palonosetrona (bolus60 IV) foi administrada no dia 1 e aprepitanto foi administrado por via oral por 3 dias (125 mg/80 mg/80 mg), a farmacocinética da palonosetrona não foi significantemente alterada (não houve alteração na AUC31 e houve 15% de aumento na Cmáx).
Um estudo em voluntários saudáveis envolvendo dose única IV de palonosetrona (0,75 mg) e metoclopramida oral em equilíbrio dinâmico (10 mg quatro vezes ao dia) não demonstrou interação farmacocinética significativa.
Em estudos clínicos controlados, Onicit injetável foi administrado com segurança com corticosteroides, analgésicos61, antieméticos62/antinauseantes, antiespasmódicos e agentes anticolinérgicos.
A palonosetrona não inibiu a atividade antitumoral de cinco agentes quimioterápicos testados (cisplatina, ciclofosfamida, citarabina, doxorrubicina e mitomicina C) em modelos tumorais murinos.
Medicamentos serotoninérgicos (como ISRSs e ISRSNs): houve relatos de síndrome serotoninérgica48 após o uso concomitante de antagonistas de 5-HT3 com outros medicamentos serotoninérgicos (incluindo ISRSs e IRSNs).
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Conservar em temperatura ambiente (entre 15 e 30°C). Não congelar. Proteger da luz. O prazo de validade do medicamento é de 24 meses a partir da data de fabricação.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
Onicit injetável é uma solução estéril, transparente, incolor, apirogênica, isotônica63 e tamponada para administração intravenosa.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Náuseas2 e vômitos3 induzidos por quimioterapia4
Onicit deve ser infundido por via intravenosa ao longo de 30 segundos em adultos e de 15 minutos em crianças e adolescentes (1 mês até 17 anos).
Náuseas2 e vômitos3 no pós-operatório
Onicit deve ser infundido por via intravenosa ao longo de 10 segundos para adultos.
Instruções para uso/manuseio: lave o acesso de infusão com solução salina normal antes e depois da administração de Onicit.
POSOLOGIA
– Náuseas2 e vômitos3 induzidos por quimioterapia4
Adultos
A dose recomendada de Onicit para adultos é de 0,25 mg, administrado como dose única aproximadamente 30 minutos antes da quimioterapia4.
Crianças e adolescentes (1 mês a 17 anos de idade)
A dose recomendada de Onicit em crianças e adolescentes é de 20 mcg/kg (a dose máxima total não deve exceder 1.500 mcg) de palonosetrona administrados por infusão intravenosa única, durante 15 minutos, com início aproximadamente 30 minutos antes da quimioterapia4.
– Náuseas2 e vômitos3 no pós-operatório
A dose recomendada de Onicit para adultos é de 0,075 mg administrados como dose única por 10 segundos, imediatamente antes da indução da anestesia10.
Os dados sobre o uso de Onicit na prevenção de náuseas2 e vômitos3 em crianças com menos de 2 anos idade são limitados.
Populações especiais:
Geriátrica: a análise farmacocinética populacional e os dados de segurança e eficácia clínica não revelaram nenhuma diferença entre pacientes com câncer5 ≥ 65 anos de idade e pacientes mais jovens (18 a 64 anos). Não é necessário ajuste de dose para esses pacientes.
Uso em pacientes pediátricos: A segurança e a eficácia de Onicit em crianças com menos de 1 mês de idade ainda não foram estabelecidas. Não há dados disponíveis.
Raça: a farmacocinética intravenosa da palonosetrona foi caracterizada em 24 indivíduos japoneses saudáveis na faixa de dose de 3 a 90 mcg/kg. A depuração corpórea total foi 25% maior em indivíduos japoneses em comparação com brancos, entretanto, não há necessidade de ajuste de dose. A farmacocinética da palonosetrona em negros não foi adequadamente caracterizada.
Comprometimento renal36: o comprometimento renal36 leve a moderado não afeta significativamente os parâmetros farmacocinéticos da palonosetrona. A exposição sistêmica total aumentou em aproximadamente 28% o comprometimento renal36 grave em relação aos indivíduos saudáveis. Não é necessário ajuste de dose para pacientes6 com qualquer grau de comprometimento renal36.
Comprometimento hepático: o comprometimento hepático não afeta significativamente a depuração corpórea total da palonosetrona em comparação aos indivíduos saudáveis. Não é necessário ajuste de dose para pacientes6 com qualquer grau de comprometimento hepático.
REAÇÕES ADVERSAS
Náuseas2 e vômitos3 induzidos por quimioterapia4
Em estudos clínicos para a prevenção de náuseas2 e vômitos3 induzidos por quimioterapia4 moderada ou altamente emetogênica, 1.374 pacientes adultos receberam a palonosetrona. As reações adversas foram semelhantes em frequência e gravidade com Onicit e a ondansetrona ou a dolasetrona. A tabela a seguir traz uma lista de todas as reações adversas relatadas por ≥ 2% dos pacientes nesses estudos clínicos (Tabela 6).
Tabela 6: Estudos de reações adversas de náuseas2 e vômitos3 induzidos por quimioterapia4, ≥ 2% em qualquer grupo de tratamento
|
Evento |
Onicit 0,25 mg |
ondansetrona 32 mg IV |
dolasetrona 100 mg IV |
|
Cefaleia64 |
60 (9%) |
34 (8%) |
32 (16%) |
|
Constipação45 |
29 (5%) |
8 (2%) |
12 (6%) |
|
Diarreia65 |
8 (1%) |
7 (2%) |
4 (2%) |
|
Tonturas50 |
8 (1%) |
9 (2%) |
4 (2%) |
|
Fadiga51 |
3 (<1%) |
4 (1%) |
4 (2%) |
|
Dor abdominal |
1 (<1%) |
2 (<1%) |
3 (2%) |
|
Insônia |
1 (<1%) |
3 (1%) |
3 (2%) |
Em outros estudos, 2 indivíduos apresentaram constipação45 grave após uma dose única de palonosetrona de aproximadamente 0,75 mg, três vezes a dose recomendada. Um paciente recebeu uma dose oral de 10 mcg/kg em um estudo de náuseas2 e vômitos3 no pós-operatório, e um indivíduo saudável recebeu uma dose IV de 0,75 mg em um estudo farmacocinético.
Em estudos clínicos, as seguintes reações adversas infrequentemente relatadas, avaliadas por investigadores como relacionadas ao tratamento ou de causalidade desconhecida, ocorreram após a administração concomitante de Onicit em pacientes adultos recebendo quimioterapia4 contra o câncer5:
Cardiovasculares: 1%: taquicardia66 não sustentada, bradicardia67, hipotensão68; < 1%: hipertensão69, isquemia70 miocárdica, extrassístoles, taquicardia66 sinusal, arritmia71 sinusal, extrassístoles supraventriculares e prolongamento de QT. Em muitos casos, a relação com Onicit foi incerta.
Dermatológicas: < 1%: dermatite72 alérgica e erupções cutâneas73.
Audição e visão74: < 1%: cinetose75, tinido, irritação ocular e ambliopia76.
Sistema gastrintestinal: 1%: diarreia65; < 1%: dispepsia77, dor abdominal superior, boca78 seca, soluços e flatulência.
Gerais: 1%: fraqueza; < 1%: fadiga51, febre79, calorões e síndrome80 do tipo gripal.
Fígado81: < 1%: aumentos transitórios assintomáticos em AST e/ou ALT e bilirrubina82. Essas alterações ocorreram predominantemente em pacientes recebendo quimioterapia4 altamente emetogênica.
Metabólicas: 1%: hipercalemia83; < 1%: flutuações eletrolíticas, hiperglicemia84, acidose metabólica85, glicosúria86, diminuição do apetite e anorexia87.
Musculoesqueléticas: < 1%: artralgia88.
Sistema nervoso89: 1%: tonturas50; < 1%: sonolência, insônia, hipersonia, parestesia90 e neuropatia91 sensorial periférica.
Psiquiátricas: 1%: ansiedade; < 1%: humor eufórico.
Sistema urinário92: < 1%: retenção urinária93.
Vasculares94: < 1%: descoloração venosa e distensão venosa.
Náuseas2 e vômitos3 no pós-operatório
As reações adversas descritas na Tabela 7 foram reportadas por ≥ 2% dos adultos que receberam 0,075 mg de Onicit por via IV imediatamente antes da indução da anestesia10 em estudos clínicos randomizados, controlados por placebo9, sendo um de Fase 2 e dois de Fase 3. As taxas dos eventos entre
o grupo da palonosetrona e o do placebo9 foram imperceptíveis. Alguns dos eventos são conhecidos por serem associados com, ou podem ser exacerbados por medicamentos perioperatórios ou intraoperatórios administrados concomitantemente nos pacientes submetidos a cirurgias de abdômen ou ginecológicas.
Veja no item 3. CARACTERÍSTICAS FARMACOLÓGICAS - FARMACOLOGIA20 CLÍNICA que os resultados dos estudos têm dados definitivos demonstrando que a palonosetrona não afeta o intervalo QT/QTc.
|
Evento |
Onicit 0,075 mg |
Placebo9 |
|
Prolongamento do intervalo QT no eletrocardiograma30 |
16 (5%) |
11 (3%) |
|
Bradicardia67 |
13 (4%) |
16 (4%) |
|
Dor de cabeça95 |
11 (3%) |
14 (4%) |
|
Constipação45 |
8 (2%) |
11 (3%) |
Tabela 7: Reações adversas dos estudos de náuseas2 e vômitos3 no pós-operatório ≥ 2% em qualquer grupo de tratamento
Nesses estudos clínicos, as seguintes reações adversas, avaliadas pelos investigadores como relacionadas ao tratamento ou de causa desconhecida, ocorreram após a administração de Onicit a pacientes adultos recebendo medicamentos peri-operatórios e intra-operatórios concomitantemente, incluindo os associados com a anestesia10.
Cardiovasculares: 1%: prolongamento do intervalo QTc no eletrocardiograma30; bradicardia67 sinusal, taquicardia66, < 1%: diminuição da pressão sanguínea, hipotensão68, hipertensão69, arritmia71, extrassístole ventricular, edema96 generalizado, diminuição da amplitude da onda T no eletrocardiograma30 e diminuição da contagem de plaquetas97. A frequência desses efeitos adversos não foi diferente do placebo9.
Dermatológicas: 1%: prurido98.
Sistema gastrintestinal: 1%: flatulência; < 1%: boca78 seca, dor abdominal superior, hipersecreção salivar, dispepsia77, diarreia65, hipomotilidade intestinal e anorexia87.
Gerais: < 1%: calafrios99.
Fígado81: 1%: aumento na AST e/ou ALT; < 1%: aumento nas enzimas hepáticas100.
Metabólicas: < 1%: hipocalemia101 e anorexia87.
Sistema nervoso89: < 1%: tonturas50.
Respiratório: < 1%: hipoventilação e laringospasmo.
Sistema urinário92: < 1%: retenção urinária93.
Experiência pós-comercialização
As seguintes reações adversas foram identificadas após o lançamento de Onicit no mercado. Essas reações foram reportadas voluntariamente a partir de uma população de tipos diferentes. Desta forma nem sempre é possível estabelecer de maneira confiável uma relação causal com a exposição ao medicamento.
Casos muito raros (< 1/10.000) de reações de hipersensibilidade (incluindo anafilaxia102, reações anafiláticas103/anafilactoides e choque104) e reações no local de aplicação (ardência, induração, desconforto e dor) foram relatados, na pós-comercialização de Onicit 0,25 mg, na prevenção de náuseas2 e vômitos3 induzidos por quimioterapia4.
População pediátrica
Tabela 8: Perfil de eventos adversos (EAs) no cenário de NVIQ
|
Classe de sistema de órgãos |
Reações adversas (< 1%) |
|
Doenças do sistema nervoso89 |
Cefaleia64, tontura105 e discinesia |
|
Doenças gerais e alterações no local de administração |
Dor no local de injeção7 |
|
Doenças da pele106 e do tecido subcutâneo107 |
Dermatite72 alérgica e doenças da pele106 |
Os eventos listados abaixo ocorreram em pacientes pediátricos com câncer5, tratados com palonosetrona 20 mcg/kg, submetidos a ciclos repetidos de quimioterapia4.
Em casos de eventos adversos, notifique pelo sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Não existe nenhum antídoto108 conhecido para Onicit. A superdose deve ser tratada com tratamento de suporte. A palonosetrona foi administrada em 50 pacientes adultos com câncer5 em uma dose de 90 mcg/kg (equivalente a 6 mg de dose fixa) como parte de um estudo de variação de dose. Essa dose é aproximadamente 25 vezes a dose recomendada de 0,25 mg para náuseas2 e vômitos3 induzidos pela quimioterapia4. Esse grupo de dose teve uma incidência22 semelhante de eventos adversos em comparação com os outros , não tendo sido observados efeitos de dose-resposta. Entretanto, não foram realizados estudos de diálise109, uma vez que, devido ao grande volume de distribuição, é improvável que a diálise109 constitua um tratamento eficaz para superdoses de palonosetrona. Uma dose intravenosa única de palonosetrona de 30 mg/kg (947 e 474 vezes a dose humana para ratos e camundongos, respectivamente, com base na área de superfície corporal) foi letal para ambos. Os principais sinais46 de toxicidade110 foram convulsões, engasgamento, palidez, cianose111 e colapso112.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
USO RESTRITO A HOSPITAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS 1.0171.0181
Farm. Resp.: Fernando C. Lemos - CRF-SP nº 16.243
Importado por:
Merck Sharp & Dohme Farmacêutica Ltda.
Av. Dr. Chucri Zaidan, 296 CNPJ 03.560.974/0001-18
São Paulo/SP Brasil
Fabricado por:
Fareva Pau, Idron, França
Embalado por:
Schering-Plough S.A. de C.V., Xochimilco, México
Licenciado sob autorização de Helsinn Healthcare S.A., Suíça, proprietária da marca.
SAC 0800 0122232