REAÇÕES ADVERSAS DEPAKENE CÁPSULA
Epilepsia1
Com base em um ensaio placebo2-controlado de terapia adjuvante para o tratamento de crises parciais complexas, o divalproato foi geralmente bem tolerado, sendo que a maioria dos eventos adversos foi considerada leve a moderada. A intolerância foi a principal razão para a descontinuação nos pacientes tratados com divalproato de sódio (6%), em relação aos pacientes tratados com placebo2 (1%). Como os pacientes foram também tratados com outros medicamentos antiepilépticos, não é possível, na maioria dos casos, determinar se os eventos adversos são associados ao divalproato de sódio somente ou à combinação deste com outros medicamentos antiepilépticos.
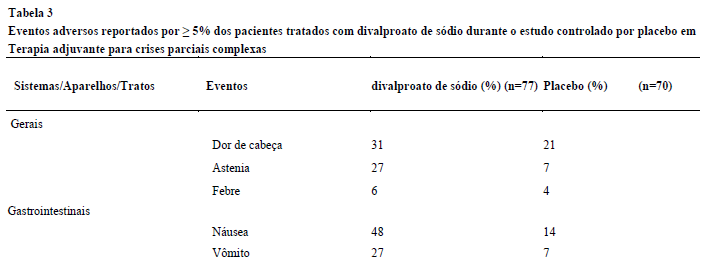
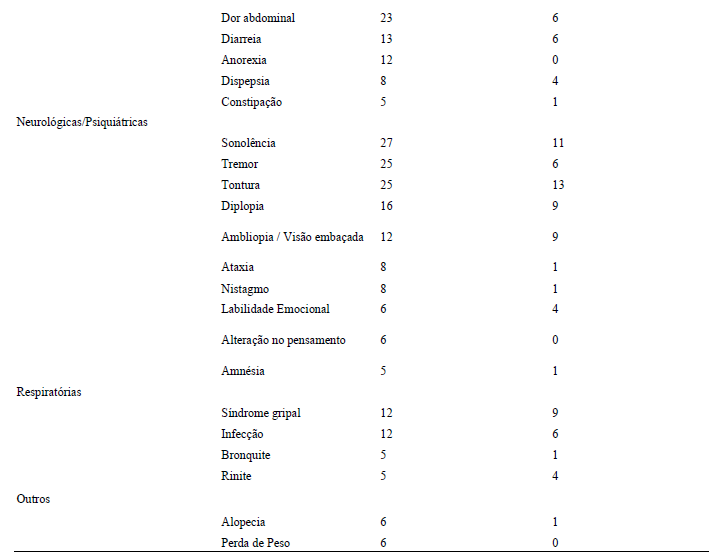
Na Tabela 3 são apresentadas as reações adversas relatadas por ≥ 5 % dos pacientes tratados com divalproato de sódio como terapia adjuvante para crises parciais complexas, com incidência3 maior do que no grupo placebo2.
Tabela 3
Eventos adversos reportados por ≥ 5% dos pacientes tratados com divalproato de sódio durante o estudo controlado por placebo2 em Terapia adjuvante para crises parciais complexas.
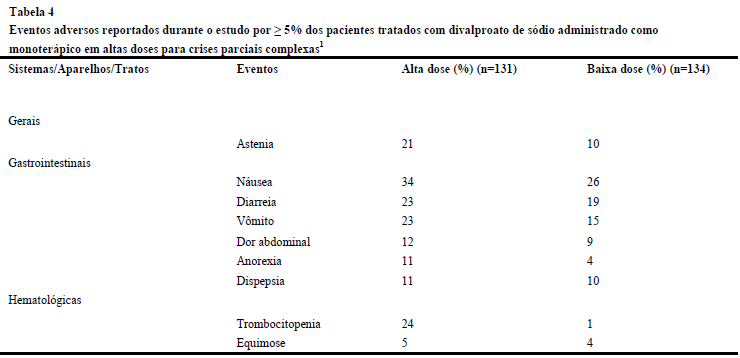
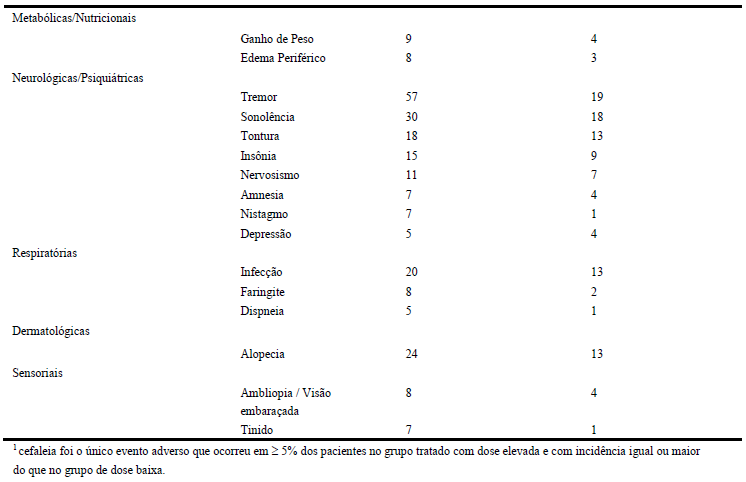
A Tabela 4 lista os eventos adversos ocorridos durante o tratamento emergencial reportados por ≥ 5% dos pacientes que ingeriram altas doses de divalproato de sódio, e para aqueles eventos adversos que ocorreram em maior proporção do que no grupo de baixa dose, em um estudo controlado de divalproato de sódio como monoterapia para crises parciais complexas.
Como os pacientes foram também tratados com outros medicamentos antiepilépticos, não é possível, na maioria dos casos, determinar se os efeitos adversos são associados ao divalproato de sódio somente ou à combinação deste com outros medicamentos antiepilépticos.
Tabela 4
Eventos adversos reportados durante o estudo por ≥ 5% dos pacientes tratados com divalproato de sódio administrado como monoterápico em altas doses para crises parciais complexas1
Os seguintes eventos adversos foram reportados por mais do que 1%, mas menos que 5% dos 358 pacientes tratados com divalproato de sódio nos estudos controlados para crises parciais complexas:
Gerais: dor nas costas4, dor no peito5 e mal estar.
Cardiovasculares: taquicardia6, hipertensão7 e palpitação8.
Gastrointestinais: aumento do apetite, flatulência, hematêmese9, eructação10, pancreatite11 e abcesso periodontal12.
Hematológicas: petéquia13.
Metabólicas/Nutricionais: AST e ALT aumentadas.
Musculoesqueléticas: mialgia14, contração muscular, artralgia15, cãibra na perna e miastenia16.
Neurológicas/Psiquiátricas: ansiedade, confusão, alteração na marcha, parestesia17, hipertonia18, incoordenação, alteração nos sonhos e transtorno de personalidade.
Respiratórias: sinusite19, tosse aumentada, pneumonia20 e epistaxe21.
Dermatológicas: rash22 cutâneo23, prurido24 e pele25 seca.
Sensoriais: alteração no paladar26, na visão27 e audição, surdez e otite média28.
Urogenitais: incontinência urinária29, vaginite30, dismenorreia31, amenorreia32 e poliúria33.
Outras Populações de Pacientes
Os eventos adversos que foram relatados com todas as formas de dosagem de valproato em estudos clínicos sobre o tratamento de epilepsia1, ou em relatos espontâneos e de outras fontes, são listados a seguir:
Gastrointestinais: os efeitos colaterais34 mais frequentemente relatados no início do tratamento são náusea35, vômito36 e indigestão. São efeitos usualmente transitórios e raramente requerem interrupção do tratamento. Diarreia37, dor abdominal e constipação38 e distúrbios gengivais (principalmente hiperplasia39 gengival) foram relatados. Tanto anorexia40 com perda de peso, quanto aumento do apetite com ganho de peso também foram relatados. A administração de comprimidos revestidos de divalproato de sódio, de liberação entérica, pode resultar na redução dos eventos adversos gastrointestinais em alguns pacientes.
Neurológicas: foram observados efeitos sedativos em pacientes sob tratamento apenas com valproato de sódio; porém, esses são mais frequentes em pacientes recebendo terapias combinadas. A sedação41 geralmente diminui com a redução de outros medicamentos antiepilépticos administrados concomitantemente. Tremores (podem ser dose-relacionados), alucinações42, ataxia43, cefaleia44, nistagmo45, diplopia46, asterixis, escotomas47, disartria48, tontura49, confusão, hipoestesia50, vertigem51, incoordenação motora, comprometimento da memória, desordem cognitiva52 e parkinsonismo foram relatados com o uso do valproato. Raros casos de coma53 ocorreram em pacientes recebendo valproato isolado ou em combinação com fenobarbital. Em raros casos, encefalopatia54, com ou sem febre55 desenvolveu-se logo após a introdução da monoterapia com valproato, sem evidência de disfunção hepática56 ou níveis plasmáticos altos inadequados. Embora a recuperação tenha sido descrita após a suspensão do medicamento, houve casos fatais em pacientes com encefalopatia54 hiperamonêmica particularmente em pacientes com distúrbios do ciclo da ureia57 subjacente (ver “5. ADVERTÊNCIAS E PRECAUÇÕES – Distúrbios do Ciclo da Ureia57 e Hiperamonemia e Encefalopatia54 associada ao uso concomitante de topiramato e Hiperamonemia”).
Houve relatos pós-comercialização de atrofia58 (reversível e irreversível) cerebral e cerebelar, temporariamente associadas ao uso de produtos que se dissociam em íon59 valproato. Em alguns casos, porém, a recuperação foi acompanhada por sequelas60 permanentes. Foram observados prejuízo psicomotor61 e atraso no desenvolvimento em crianças com atrofia58 cerebral decorrente da exposição ao valproato quando em ambiente intrauterino (ver “5. ADVERTÊNCIA E PRECAUÇÕES – Atrofia58 Cerebral/Cerebelar”).
Dermatológicas: perda temporária de cabelos, distúrbios relacionados aos cabelos (como alterações de cor, anormalidades na textura e no crescimento dos cabelos), erupções cutâneas62, fotossensibilidade, prurido24 generalizado, eritema multiforme63 e síndrome de Stevens-Johnson64. Casos raros de necrólise epidérmica tóxica65 foram relatados, incluindo um caso fatal num lactente66 de seis meses de idade recebendo valproato e vários outros medicamentos concomitantes. Um caso adicional de necrólise epidérmica tóxica65 resultante em óbito67 foi relatado num paciente com 35 anos de idade com AIDS, recebendo vários medicamentos concomitantes e com histórico de múltiplas reações cutâneas62 a medicamento.
Reações cutâneas62 sérias foram relatadas com o uso concomitante de lamotrigina e valproato (ver “6. INTERAÇÕES MEDICAMENTOSAS – Lamotrigina”).
Psiquiátricas: observaram-se casos de instabilidade emocional, depressão, psicose68, agressividade, hiperatividade psicomotora69, hostilidade, agitação, distúrbio de atenção, comportamento anormal, desordem do aprendizado e deterioração do comportamento.
Musculoesqueléticas: fraqueza - foi verificado em estudos, relatos de diminuição de massa óssea, levando potencialmente a osteoporose70 e osteopenia, durante tratamento por longo período com medicações anticonvulsivantes, incluindo o valproato. Alguns estudos indicaram que o suplemento de cálcio e vitamina71 D pode ser benéfico à pacientes crônicos em terapia com valproato.
Hematológicas: trombocitopenia72 e inibição da fase secundária da agregação plaquetária (ver “5. ADVERTÊNCIAS E PRECAUÇÕES – Geral” e “6. INTERAÇÕES MEDICAMENTOSAS – Varfarina”), que podem ser evidenciadas por alteração do tempo de sangramento, petéquias73, hematomas74, epistaxe21 e hemorragia75. Linfocitose relativa, macrocitose, hipofibrinogenemia, leucopenia76, eosinofilia77, anemia78 incluindo macrocítica com ou sem deficiência de folato, supressão da medula óssea79, pancitopenia80, anemia78 aplástica, agranulocitose81 e porfiria82 aguda intermitente83 foram observadas.
Hepáticas84: são frequentes pequenas elevações de transaminases (AST e ALT) e de DHL, que parecem estar relacionadas às doses. Ocasionalmente, os resultados de exames de laboratório incluem também aumentos de bilirrubina85 sérica e alterações de outras provas de função hepática56. Tais resultados podem refletir hepatotoxicidade86 potencialmente grave (ver “5. ADVERTÊNCIAS E PRECAUÇÕES – Hepatotoxicidade86”).
Endócrinas: menstruação87 irregular, amenorreia32 secundária, aumento das mamas88, galactorreia89 e tumefação90 da glândula parótida91.
Hiperandrogenismo (hirsutismo92, virilismo, acne93, padrão masculino de alopecia94, e/ou aumento no nível de andrógenos95). Testes anormais da função da tireoide96, incluindo hipotireoidismo97 (ver “5. ADVERTÊNCIAS E PRECAUÇÕES – Geral”). Existem raros relatos espontâneos de doença do ovário98 policístico. A relação causa e efeito não foi estabelecida. Pancreáticas: foi relatada pancreatite11 aguda em pacientes recebendo valproato, incluindo raros casos fatais (ver “5. Advertências e Precauções – Pancreatite11”).
Metabólicas: hiperamonemia (ver “5. Advertências e Precauções – Hiperamonemia”), hiponatremia99 e secreção de HAD alterada. Existem raros relatos de síndrome100 de Fanconi ocorrendo principalmente em crianças. Diminuição das concentrações de carnitina também foi observada, embora a relevância clínica deste achado seja desconhecida. Hiperglicinemia (elevada concentração plasmática de glicina) foi associada à evolução fatal em um paciente com hiperglicinemia não cetótica preexistente.
Urogenitais: enurese101, insuficiência renal102, nefrite103 tubulo-intersticial104 e infecção105 do trato urinário106.
Sensoriais: perda auditiva, irreversível ou reversível, foi relatada; no entanto, a relação causa e efeito não foi determinada. Otalgia107 também foi relatada.
Neoplásicas108 benignas, malignas e inespecíficas (incluindo cistos e pólipos109): Síndrome100 mielodisplásica.
Respiratórias, torácicas e mediastinais: Efusão110 pleural.
Outras: reação alérgica111, anafilaxia112, edema113 de extremidades, lupus114 eritematoso115, rabdomiólise116, deficiência de biotina/biotinidase, dor nos ossos, tosse aumentada, pneumonia20, otite média28, bradicardia117, vasculite118 cutânea119, febre55 e hipotermia120.
Mania
Apesar da segurança e eficácia do ácido valpróico não terem sido avaliadas no tratamento de episódios maníacos associados com distúrbio bipolar, os seguintes eventos adversos não listados anteriormente foram relatados por 1% ou mais dos pacientes em dois estudos clínicos placebo2-controlados com divalproato de sódio em comprimidos.
Gerais: calafrios121, dor na nuca e rigidez do pescoço122.
Cardiovasculares: hipotensão123, hipotensão123 postural e vasodilatação.
Gastrointestinais: incontinência fecal124, gastroenterite125 e glossite126.
Musculoesqueléticas: artrose127.
Neurológicas: agitação, reação catatônica, hipocinesia, reflexo aumentado, discinesia tardia128 e vertigem51.
Dermatológicas: furunculose, erupções maculopapulares e seborreia129.
Sensoriais: conjuntivite130, olho131 ressecado e dor ocular.
Urogenitais: disúria132.
Enxaqueca133
Apesar da segurança e eficácia do ácido valpróico não terem sido avaliadas na profilaxia de enxaqueca133, os seguintes eventos adversos não listados anteriormente foram relatados por 1% ou mais dos pacientes em dois estudos clínicos placebo2-controlados com divalproato de sódio em comprimidos.
Gerais: edema113 facial.
Gastrointestinais: boca134 seca, estomatite135.
Urogenitais: cistite136, metrorragia137 e hemorragia vaginal138.
Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária – NOTIVISA, disponível em www.anvisa.gov.br/hotsite/notivisa/index.htm, ou para a Vigilância Sanitária Estadual ou Municipal.