
CARACTERISTICAS FARMACOLÓGICAS CEZOLIN
Descrição: cefazolina sódica é uma cefalosporina semi-sintética para administração parenteral. É o sal sódico do 3-{[(5-metil-1,3,4- tiadiazol-2-il)tiol]meti l}-8-oxo-7-[2-(1 H-tetrazol-1-i l)acetamido]-5- tia-1-azabiciclo[4.2.0]octo-2-eno-2-ácidocarboxílico. O teor de sódio é 48,3 mg por grama1 de cefazolina sódica.
Farmacologia2 Humana: após administração intramuscular em voluntários normais, as concentrações séricas médias de cefazolina foram 37 mcg/mL em 1 hora e 3 mcg/mL em 8 horas com uma dose de 500 mg e, 64 mcg/mL em 1 hora e 7 mcg/mL em 8 horas com dose de 1 g.
Após a administração intravenosa de cefazolina em voluntários normais, as concentrações séricas médias apresentaram um pico de aproximadamente 185 mcg/mL e foram de aproximadamente 4 mcg/mL em 8 horas, com uma dose de 1 g. A meia-vida sérica da cefazolina é aproximadamente 1,8 hora após administração l.V. e aproximadamente 2 horas após administração l.M. Em um estudo (usando voluntários normais) com infusões intravenosas constantes, de 3,5 mg/kg durante 1 hora (aproximadamente 250 mg) e 1,5 mg/kg nas 2 horas seguintes (aproximadamente 100 mg), a cefazolina produziu um nível sérico constante de aproximadamente 28 mcg/mL na terceira hora. Estudos com pacientes hospitalizados com infecção3 indicam que a cefazolina injetável produz níveis séricos médios equivalentes aos observados em voluntários normais.
Em pacientes sem doença obstrutiva biliar, os níveis na bile4 podem atingir ou exceder até 5 vezes os níveis séricos; porém, em pacientes com doença obstrutiva biliar, os níveis biliares de cefazolina são consideravelmente menores que os níveis séricos (<1,0 mcg/mL).
No líquido sinovial5, os níveis de cefazolina são comparáveis aos alcançados no soro6 cerca de 4 horas após a administração. Estudos no sangue do cordão umbilical7 demonstram pronta transferência da cefazolina através da placenta. A cefazolina está presente em concentrações muito baixas no leite de mães que estão amamentando. A cefazolina é excretada inalterada na urina8. Nas primeiras 6 horas aproximadamente 60% do medicamento são excretados na urina8, aumentando para 70% a 80% em 24 horas. A cefazolina atinge concentrações urinárias máximas de aproximadamente 2400 mcg/mL e 4000 mcg/mL após doses intramusculares de 500 mg e 1 g, respectivamente. Em pacientes submetidos à diálise peritoneal9 (2 Litros/h), a cefazolina produziu
níveis séricos médios de aproximadamente 10 e 30 mcg/mL após 24 horas de instilação de uma solução de diálise10 contendo 50 mg/L e 150mg/L, respectivamente. Os níveis médios de Pico foram 29 mcg/ml com 50mg/L (três pacientes), 72 mcg/mL com 150 mg/L (seis pacientes). A administração intraperitoneal da cefazolina é geralmente bem tolerada. Estudos controlados em vonluntários adultos normais recebendo 1g, 4 vezes ao dia, durante 10 dias, monitorando exames hematológicos, TGO, TGP, bilirrubinas11, fosfatase alcalina12, uremia13, creatinina14 e exames de urina8, não demonstraram qualquer alteração clinicamente significativa que fosse atribuída à cefazolina.
- RESULTADOS DE EFICÁCIA:
Microbiologia: testes in vitro demonstraram que a ação bactericida das cefalosporinas resulta da inibição da síntese da parede celular. A cefazolina é ativa in vitro e em infecções15 clínicas contra os seguintes microrganismos:
Staphylococcus aureus (incluindo cepas16 produtoras de penicilinase);
Staphylococcus epidermidis;
Estreptococos beta-hemolíticos do Grupo A e outras cepas16 de estreptococos (muitas cepas16 de enterococos são resistentes);
Streptococcus pneumoniae;
KIebsieIIa spp.;
Escherichia coIi;
Enterobacter aerogenes;
Proteus mirabilis;
Haemophilus influenzae.
Obs.: Estafilococos meticilina-resistentes são uniformemente resistentes à cefazolina.
A maioria das cepas16 de Proteus indol positivos (Proteus vulgaris), Enterobacter cloacae, Morganella morganii e Providencia rettgeri é resistente. Serratia, Pseudomonas, Mima, Herellea são quase uniformemente resistentes à cefazolina.
Testes de Suscetibilidade
Técnicas de difusão: Métodos quantitativos que requerem a medição do diâmetro do halo proporcionam as estimativas mais precisas da suscetibilidade de microrganismos aos antibióticos. Um procedimento deste tipo (Ref.1) tem sido recomendado para testes de suscetibilidade à cefazolina com uso de discos.
O Teste de suscetibilidade padronizado, com um único disco (Ref.1,2) com 30 mcg de cefazolina, deve ser interpretado de acordo com os seguintes critérios:

Um resultado “suscetível” indica que o patógeno provavelmente será inibido pelos níveis sangüíneos normalmente alcançados, respondendo à terapia. Um resultado “intermediário” sugere que o microrganismo deve ser suscetível se altas doses forem usadas ou se a infecção3 estiver confinada nos tecidos e líquidos onde altos níveis do antibiótico são atingidos (por ex.: Urina8).
Um resultado “resistente” indica que as concentrações alcançadas não serão suficientes para inibir o microorganismo e outra terapia deve ser selecionada.
Procedimentos padronizados requerem o uso de microorganismo de controle laboratorial. O disco de cefazolina 30mcg deve apresentar os seguintes halos de inibição:
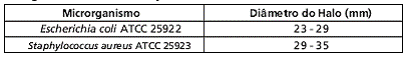
Técnicas de Diluição: Usar o método de diluição padronizado pelo Comitê Nacional de Padrões para Laboratório Clínico (caldo ou ágar) ou equivalente. Os valores de concentração inibitória mínima (CIM) obtidos devem ser interpretados de acordo com os seguintes critérios:

Um resultado “suscetível” indica que o patógeno provavelmente será inibido pelos níveis sanguíneos normalmente alcançados. Um resultado “resistente” indica que as concentrações alcançadas não serão suficientes para inibir o microrganismo e outra terapia deve ser selecionada.
Procedimentos padronizados requerem o uso de microrganismo de controle laboratorial. A cefazolina – padrão deve fornecer os seguintes valores de CIM:



