INDICAÇÕES DEPACON
DEPACON (valproato de sódio) é uma alternativa intravenosa para pacientes1 que estejam temporariamente impossibilitados de receber medicamentos com valproato por via oral.
DEPACON é destinado como monoterápico ou como terapia adjuvante ao tratamento de pacientes com crises parciais complexas, que ocorrem tanto de forma isolada ou em associação com outros tipos de crises.
DEPACON também é destinado como monoterápico ou como terapia adjuvante no tratamento de quadros de ausência simples e complexa.
Ausência simples é definida como breve obscurecimento sensorial ou perda de consciência, acompanhada de um certo número de descargas epilépticas generalizadas, sem outros sinais2 clínicos detectáveis. A ausência complexa é a expressão utilizada quando outros sinais2 também estão presentes.
- 2. RESULTADOS DE EFICÁCIA
Os estudos descritos neste item foram conduzidos com divalproato de sódio oral.
Epilepsia3
Crises Parciais Complexas (CPC)
A eficácia do divalproato de sódio na redução da incidência4 de crises parciais complexas (CPC) que ocorrem de forma isolada ou em associação com outros tipos de crises foi estabelecida em dois ensaios controlados usando divalproato de sódio comprimidos revestidos.
Em um estudo multiclínico, placebo5-controlado, empregado como terapia adjuvante, 144 pacientes que apresentaram oito ou mais CPCs durante oito semanas, por um período de oito semanas de monoterapia com doses de fenitoína ou carbamazepina suficientes para assegurar as concentrações plasmáticas no "intervalo terapêutico", foram randomizados para receber, em adição às suas medicações antiepiléticas originais, divalproato de sódio ou placebo5.
Pacientes foram escolhidos ao acaso para prosseguir os estudos para um total de 16 semanas. A tabela 1 descreve os achados.
A Figura 1 apresenta a proporção de pacientes (eixo X) cuja porcentagem de redução das taxas de crises parciais complexas no início foi pelo menos tão elevada quanto a indicada no eixo Y no estudo de tratamento adjuvante. Uma redução percentual positiva indica uma melhora (ou seja, redução na frequência das crises), enquanto que uma redução percentual negativa indica uma piora.
Deste modo, em uma exposição deste tipo, a curva que demonstra um tratamento efetivo é deslocada para a esquerda da curva do placebo5. O resultado demonstrou que a proporção de pacientes que atingiram um determinado nível de melhoria com divalproato de sódio foi consistentemente maior do que os pacientes que usaram placebo5. Por exemplo, 45% dos pacientes tratados com divalproato de sódio tiveram uma redução na taxa de CPCs maior ou igual a 50%, comparado a 23% de melhoria para os pacientes que usaram placebo5.
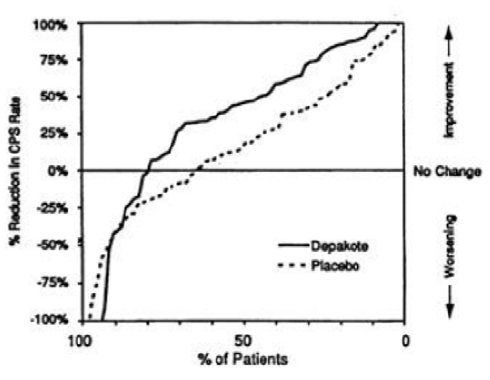
Figura 1
O segundo estudo avaliou a capacidade do divalproato de sódio em reduzir a incidência4 de CPCs como monoterapia antiepilética. O estudo comparou a incidência4 de CPCs entre os pacientes randomizados para receber altas ou baixas doses de tratamento. Os pacientes foram selecionados para participarem dos estudos somente se:
1) apresentassem duas ou mais CPCs por quarto semanas, durante um período de oito a doze semanas de monoterapia com doses adequadas de anti-epiléticos (fenitoína, carbamazepina, fenobarbital, primidona); e
2) pacientes que passaram por uma transição de duas semanas bem sucedidas para divalproato de sódio.
Os pacientes foram então submetidos à ingestão das doses determinadas, com diminuição gradual
da medicação antiepilética concomitante, por um período de 22 semanas. Porém, menos de 50% dos pacientes finalizaram os estudos. Nos pacientes convertidos à monoterapia com divalproato de
sódio, a média total das concentrações de valproato durante a monoterapia foram de 71 e 123 mcg/mL para a dose baixa e dose alta, respectivamente.
A Tabela 2 apresenta os achados para todos os pacientes randomizados que passaram por pelo menos uma avaliação pós-randomização.
A Figura 2 apresenta a proporção de pacientes (eixo X) cuja porcentagem de redução nas taxas de crises parciais complexas no início foi pelo menos tão elevada quanto a indicada no eixo Y do estudo monoterápico. Uma redução percentual positiva indica uma melhora (ou seja, redução na frequência das crises), enquanto que uma redução percentual negativa indica uma piora. Deste modo, em uma exposição deste tipo, a curva que demonstra um tratamento mais efetivo é deslocada para a esquerda da curva que demonstra um tratamento menos efetivo. Os resultados mostraram que a redução na incidência4 de CPCs foi significantemente maior quando administrada altas doses de divalproato de sódio. Por exemplo, quando da alteração da monoterapia de carbamazepina, fenitoína, fenobarbital ou primidona para administração de doses elevadas de divalproato de sódio como monoterapia, 63% dos pacientes não sofreram alteração ou sofreram uma redução de taxas de epilepsia3 parcial complexa, em comparação com 54% dos pacientes que receberam doses mais baixas de divalproato de sódio.
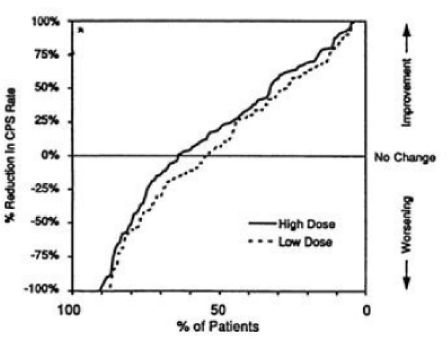
Figura 2
O valproato de sódio injetável foi geralmente bem tolerado em ensaios clínicos6 envolvendo 111 homens adultos sadios e 352 pacientes epilépticos submetidos a doses de 125 a 6000mg (dose total diária).
Um total de 2% dos pacientes descontinuaram o tratamento com valproato de sódio injetável devido a reações adversas.
Referências Bibliográficas
Caso haja interesse em conhecer as referências bibliográficas e/ou estudos clínicos disponíveis para este medicamento, por favor, entre em contato com nosso Serviço de Atendimento ao Consumidor
– Abbott Center através do telefone 0800 7031050.
- 3. CARACTERÍSTICAS FARMACOLÓGICAS
Farmacodinâmica
O valproato de sódio aparece no sangue7 como íon8 valproato. O mecanismo pelo qual o valproato exerce seu efeito terapêutico não está estabelecido, mas sua atividade na epilepsia3 parece estar relacionada com o aumento dos níveis do ácido gama-aminobutírico (GABA9) no cérebro10.
Farmacocinética
Absorção e biodisponibilidade: para doses equivalentes de produtos de valproato intravenoso (I.V.) e valproato oral são esperados resultados equivalentes de Cmáx e Cmin e uma exposição sistêmica total ao íon8 valproato. Entretanto, a taxa de absorção do íon8 valproato pode variar com a formulação usada. Essas diferenças passam a ter menor relevância clínica quando se atinge o estado de equilíbrio em condições de uso crônico11 no tratamento da epilepsia3.
A administração de comprimidos de divalproato de sódio e valproato I.V. (administrado por infusão em 1 hora), 250 mg a cada 6 horas, por 4 dias, a 18 voluntários masculinos e sadios, resultou em equivalentes ASC, Cmáx e Cumin no estado de equilíbrio, da mesma forma como após a primeira dose. O Tmáx após valproato de sódio I.V. ocorre ao final de 1 hora de infusão, enquanto o Tmáx após dose oral de divalproato de sódio ocorre em aproximadamente 4 horas. Devido à cinética12 do valproato não ligado ser linear, a bioequivalência do valproato de sódio e do divalproato de sódio até a dose máxima recomendada de 60 mg/kg/dia pode ser assumida. A ASC e o Cmáx após a administração de 500 mg de valproato I.V. como dose única em infusão por uma hora e dose única de 500 mg de ácido valproico xarope a 17 voluntários masculinos sadios também foi equivalente.
Pacientes mantidos com doses de 750 mg a 4250 mg diárias (em doses divididas a cada 6 horas) de ácido valproico sob a forma de divalproato de sódio isolado (n=24) ou com outro antiepiléptico [carbamazepina (n=15), fenitoína (n=11) ou fenobarbital (n=1)] mostraram níveis plasmáticos comparáveis para ácido valproico quando se mudou de divalproato de sódio oral para valproato I.V. (infusão de 1 hora).
Distribuição: Ligação às proteínas13: a ligação do valproato às proteínas13 plasmáticas é dependente da concentração e a fração livre aumenta em aproximadamente 10% com concentração de 40 mcg/mL para 18,5% com concentração de 130 mcg/mL. A ligação proteica do valproato é reduzida em idosos, em pacientes com doenças hepáticas14 crônicas, em pacientes com insuficiência renal15 e na presença de outros medicamentos (por exemplo, ácido acetilsalicílico). Por outro lado, o valproato pode deslocar algumas drogas ligadas às proteínas13 (por exemplo: fenitoína, carbamazepina, varfarina e tolbutamida) (ver “6. INTERAÇÕES MEDICAMENTOSAS” para mais informações sobre interações farmacocinéticas de valproato com outras substâncias).
Distribuição no SNC16: as concentrações de valproato no fluido cérebro10-espinhal aproximam-se das concentrações de valproato não ligado às proteínas13 no plasma17 (aproximadamente 10% da concentração total).
Metabolismo18: o valproato é metabolizado quase que totalmente pelo fígado19. Em pacientes adultos em regime de monoterapia, 30-50% de uma dose administrada aparece na urina20 como um conjugado glicuronídeo. Beta-oxidação mitocondrial é outra via metabólica importante, correspondendo tipicamente a mais de 40% da dose. Usualmente, menos de 15 a 20% da dose é eliminada por outros mecanismos oxidativos. Menos de 3% de uma dose administrada é excretada na urina20 de forma inalterada. A relação entre dose e concentração total de valproato não é linear; a concentração não aumenta proporcionalmente com a dose, mas aumenta numa extensão menor, devido às proteínas13 plasmáticas de ligação que se saturam. A cinética12 da droga não ligada é linear.
Eliminação: as médias da depuração plasmática e do volume de distribuição para o valproato total são de 0,56 L/h/1,73 m2 e 11 L/1,73 m2, respectivamente.
A média do tempo de meia-vida para monoterapia com valproato após 60 minutos de uma infusão intravenosa de 1000 mg foi de aproximadamente 16 ± 3 horas. Isto se aplica primariamente a pacientes que não estejam recebendo medicamentos que afetem o sistema de metabolização enzimática. Por exemplo, pacientes recebendo medicamentos antiepilépticos indutores de enzimas (carbamazepina, fenitoína e fenobarbital) irão depurar o valproato mais rapidamente. Devido a estas alterações na depuração do valproato, a monitoração das concentrações dos antiepilépticos deverá ser intensificada sempre que fármacos antiepilépticos concomitantes forem introduzidos ou retirados.
Populações especiais
Neonatos21: crianças nos dois primeiros meses de vida tem uma marcada diminuição na capacidade de eliminação de valproato, quando comparadas a crianças mais velhas e adultos. Isto é resultado da depuração reduzida (talvez devido ao desenvolvimento tardio de glucuronosiltransferase e outros sistemas de enzimas envolvendo a eliminação do valproato), assim como o volume aumentado de distribuição (em parte devido à diminuição das proteínas13 de ligação plasmática). Por exemplo, em um estudo, a meia-vida em crianças com menos de 10 dias variou entre 10 a 67 horas comparado a uma faixa de 7 a 13 horas em crianças com mais de dois meses.
Crianças: pacientes pediátricos (entre 3 meses e 10 anos de idade) tem depurações 50% mais altas em relação aos adultos, expressas em peso (isto é, mL/min/kg). Acima dos 10 anos de idade, as crianças tem parâmetros farmacocinéticos que se aproximam dos adultos.
Idosos: pacientes idosos (entre 68 e 89 anos de idade) tem uma capacidade diminuída de eliminação de valproato quando comparados a adultos jovens (entre 22 a 26 anos). A depuração intrínseca é reduzida em 39%; a fração livre de valproato aumenta em 44%; portanto, a dosagem inicial deverá ser reduzida em idosos (ver “8. POSOLOGIA E MODO DE USAR”).
Sexos: não existem diferenças na depuração em relação à área de superfície corporal ajustada entre homens e mulheres (4,8 ± 0,17 e 4,7 ± 0,07 L/h/1,73 m2, respectivamente).
Etnias: os efeitos de diferentes raças na cinética12 de valproato não foram estudados.
Doenças hepáticas14: ver “4. CONTRAINDICAÇÕES” e “5. ADVERTÊNCIAS E PRECAUÇÕES – Hepatoxicidade”. Doenças hepáticas14 diminuem a capacidade de eliminação do valproato. Em um estudo, a depuração de valproato livre foi diminuída em 50% em sete pacientes com cirrose22 e em 16% em quatro pacientes com hepatite23 aguda, em comparação com seis indivíduos saudáveis. Nesse estudo, a meia-vida do valproato foi aumentada de 12 a 18 horas. Doenças hepáticas14 estão também associadas ao decréscimo das concentrações de albumina24 e a grandes frações não-ligadas de valproato (aumento de 2 a 2,6 vezes). Consequentemente, a monitorização das concentrações totais pode ser enganosa, uma vez que as concentrações livres podem estar substancialmente elevadas nos pacientes com doença hepática25, enquanto que as concentrações totais podem parecer normais.
Doenças renais: uma pequena redução (27%) na depuração de valproato não ligado tem sido relatada em pacientes com insuficiência renal15 (depuração de creatinina26 menor que 10 mL/min); no entanto, a hemodiálise27 tipicamente reduz as concentrações de valproato em torno de 20%. Portanto, ajustes de doses não são necessários em pacientes com insuficiência renal15. A ligação protéica nestes pacientes está substancialmente reduzida; assim, a monitorização das concentrações totais pode ser enganosa.
Níveis plasmáticos e efeitos clínicos: A relação entre concentração plasmática e resposta clínica não está totalmente esclarecida. Um fator contribuidor é a concentração não linear de valproato ligado à proteína, o que afeta a depuração da substância. Então, a monitoração do valproato sérico total não pode fornecer um índice confiável das espécies bioativas de valproato.
Por exemplo, tendo em vista que a concentração de valproato é dependente das proteínas13 plasmáticas de ligação, a fração livre aumenta de aproximadamente 10% em 40 mcg/mL para 18,5% em 130 mcg/mL. Frações livres maiores do que o esperado podem ocorrer em idosos, pacientes hiperlipidêmicos e em pacientes com doenças hepáticas14 e renais.
Epilepsia3: o intervalo terapêutico na epilepsia3 é comumente considerado entre 50 e 100 mcg/mL de valproato total, embora alguns pacientes possam ser controlados com menores ou maiores concentrações plasmáticas. Doses equivalentes de valproato de sódio e divalproato de sódio resultam em níveis plasmáticos equivalentes do íon8 valproato (ver “3. PROPRIEDADES FARMACOCINÉTICAS”).
- 4. CONTRAINDICAÇÕES
DEPACON (valproato de sódio) é contraindicado para uso por pacientes com:
• Conhecida hipersensibilidade ao divalproato de sódio ou aos demais componentes da fórmula do produto;
• Doença ou disfunção hepáticas14 significativas;
• Conhecida desordem na mitocôndria28 causada por mutação29 na DNA polimerase mitocondrial γ (POLG; ou seja, Síndrome30 de Alpers-Huttenlocher) e crianças com menos de 2 anos com suspeita de possuir desordem relacionada à POLG;
• Conhecido distúrbio do ciclo da ureia31 (DCU);
• Doença do sangue7 conhecida como Porfiria32;
DEPACON (valproato de sódio) é contraindicado na profilaxia de enxaqueca33 por mulheres grávidas.
- 5. ADVERTÊNCIAS E PRECAUÇÕES
Gerais: pelo fato de terem sido relatados casos de alterações na fase secundária da agregação plaquetária, trombocitopenia34 (ver “5. ADVERTÊNCIAS E PRECAUÇÕES – Trombocitopenia34”) e anormalidade nos parâmetros da coagulação35 (ex. fibrinogênio36 baixo), recomenda-se a contagem de plaquetas37 e realização de testes de coagulação35 antes de iniciar o tratamento e depois, periodicamente. Os pacientes com indicação de cirurgias eletivas38 que estão recebendo divalproato de sódio devem ser monitorados com relação à contagem de plaquetas37 e testes de coagulação35 antes da cirurgia.
Em um estudo clínico de divalproato de sódio como monoterapia em pacientes com epilepsia3, 34/126 pacientes (27%) recebendo aproximadamente 50mg/Kg/dia em média, tiveram pelo menos um valor menor que 75 x 109 plaquetas37 por litro.
Aproximadamente metade dos pacientes tiveram o tratamento descontinuado e o retorno na contagem normal das plaquetas37. Nos pacientes restantes, a contagem de plaquetas37 normalizou-se com a continuidade do tratamento. Neste estudo, a probabilidade de trombocitopenia34 aparece aumentar significativamente em concentrações de valproato maiores que 110 mcg/mL em mulheres ou 135 mcg/mL em homens. Evidências de hemorragia39, manchas roxas ou desordem na hemostasia40/coagulação35 é um indicativo para a redução da dose ou interrupção da terapia.
Uma vez que o divalproato de sódio pode interagir com medicamentos administrados concomitantemente capazes de induzir enzimas, determinações periódicas da concentração plasmática de valproato e medicamentos concomitantes são recomendadas durante a terapia inicial (ver “6. INTERAÇÕES MEDICAMENTOSAS”). O valproato é eliminado parcialmente pela urina20, como metabólito41 cetônico, o que pode prejudicar a interpretação dos resultados do teste de corpos cetônicos na urina20.
Foram relatadas alterações nos testes da função da tireoide42 associadas ao uso de valproato. Desconhece-se o significado clínico desse fato.
Há estudos “in vitro” que sugerem que o valproato estimula a replicação dos vírus43 HIV44 e CMV em certas condições experimentais. A consequência clínica, se houver, não é conhecida. Adicionalmente, a relevância dessas descobertas “in vitro” é incerta para pacientes1 recebendo terapia antirretroviral supressiva máxima. Entretanto, estes dados devem ser levados em consideração ao se interpretar os resultados da monitorização regular da carga viral em pacientes infectados pelo HIV44 recebendo valproato ou no acompanhamento clínico de pacientes infectados por CMV.
Os pacientes com deficiência subjacente de carnitina-palmitoil transferase (CPT) tipo II devem ser advertidos do alto risco de rabdomiólise45 durante o tratamento com valproato.
Hepatotoxicidade46: casos de insuficiência hepática47 resultando em fatalidade ocorreram em pacientes recebendo ácido valproico. Estes incidentes48 usualmente ocorreram durante os primeiros seis meses de tratamento. Hepatotoxicidade46 grave ou fatal pode ser precedida por sintomas49 não específicos, como mal-estar, fraqueza, letargia50, edema51 facial, anorexia52 e vômitos53. Em pacientes com epilepsia3, a perda de controle de crises também pode ocorrer. Os pacientes devem ser cuidadosamente monitorizados quanto ao aparecimento desses sintomas49. Testes de função hepática25 deverão ser realizados antes do início do tratamento e em intervalos frequentes após iniciado, especialmente durante os primeiros seis meses. No entanto, os médicos não devem confiar totalmente na bioquímica sérica, uma vez que estes exames nem sempre apresentam alterações, sendo, portanto, fundamental a obtenção de história clínica e realização de exames físicos cuidadosos. Deve-se ter muito cuidado quando divalproato de sódio for administrado em pacientes com história anterior de doença hepática25. Pacientes em uso de múltiplos anticonvulsivantes, crianças, pacientes com doenças metabólicas congênitas54, com doença convulsiva grave associada a retardo mental e pacientes com doença cerebral orgânica, podem ter um risco particular. A experiência tem demonstrado que crianças abaixo de dois anos de idade apresentam um risco consideravelmente maior de desenvolver hepatotoxicidade46 fatal, especialmente aquelas com condições anteriormente mencionadas. Quando o valproato de sódio for usado neste grupo de pacientes, deverá ser administrado com extremo cuidado e como agente único. Os benefícios da terapia devem ser avaliados em relação aos riscos. A experiência em epilepsia3 tem indicado que a incidência4 de hepatotoxicidade46 fatal decresce consideravelmente, de forma progressiva, em pacientes mais velhos. O medicamento deve ser descontinuado imediatamente na presença de disfunção hepática25 significativa, suspeita ou aparente. Em alguns casos, a disfunção hepática25 progrediu apesar da descontinuação do medicamento (ver “4. CONTRAINDICAÇÕES”).
Valproato de sódio é contraindicado em pacientes com conhecida desordem da mitocôndria28 causada por mutação29 na DNA polimerase γ (POLG, ou seja, Síndrome30 de Alpers-Huttenlocher) e crianças com menos de 2 anos com suspeita de possuir desordem relacionada a POLG (ver “4. CONTRAINDICAÇÕES”).
Insuficiência hepática47 aguda induzida por valproato e mortes relacioanadas à doença hepática25 têm sido reportadas em pacientes com síndrome30 neurometabólica hereditária causada por mutação29 no gene da DNA polimerase γ (POLG, ou seja, Síndrome30 de Alpers-Huttenlocher) em uma taxa maior do que aqueles sem esta síndrome30.
Deve-se suspeitar de desordens relacionadas à POLG em pacientes com histórico familiar ou sintomas49 sugestivos de uma desordem relacionada à POLG, incluindo, mas não limitado encefalopatia55 inexplicável, epilepsia3 refrataria (focal, mioclônica56), estado de mal epilético na apresentação, atrasos no desenvolvimento, regressão psicomotora57, neuropatia58 sensomotora axonal, miopatia59, ataxia60 cerebelar, oftalmoplegia, ou migrânea61 complicada com aura occipital. O teste para mutação29 de POLG deve ser realizado de acordo com a prática clínica atual para avaliação diagnóstica dessa desordem.
Em pacientes maiores de 2 anos com suspeita clínica de desordem mitocondrial hereditária o valproato de sódio deve ser usado apenas após tentativa e falha de outro anticonvulsivante. Este grupo mais velho de pacientes deve ser monitorado durante o tratamento com valproato de sódio para desenvolvimento de lesão62 hepática25 aguda com avaliação clínica regular e monitoramento dos testes de função hepática25.
Pancreatite63: casos de pancreatite63 envolvendo risco de morte foram relatados tanto em crianças como em adultos que receberam valproato. Alguns desses casos foram descritos como hemorrágicos64 com rápida progressão dos sintomas49 iniciais a óbito65. Alguns casos ocorreram logo após o início do uso, mas também após vários anos de uso. O índice baseado nos casos relatados excede o esperado na população em geral e houve casos nos quais a pancreatite63 recorreu após nova tentativa com valproato. Em estudos clínicos, ocorreram 2 casos de pancreatite63 em 2416 pacientes sem etiologia66 alternativa, representando 1044 pacientes ao ano do experimento. Pacientes e responsáveis devem ser advertidos que dor abdominal, náusea67, vômitos53 e/ou anorexia52, podem ser sintomas49 de pancreatite63, requerendo avaliação médica imediata. Se for diagnosticada pancreatite63, o valproato deverá ser descontinuado. O tratamento alternativo para a condição médica subjacente deve ser iniciado conforme clinicamente indicado.
Distúrbios do ciclo da ureia31 (DCU): foi relatada encefalopatia55 hiperamonêmica, algumas vezes fatal, após o início do tratamento com valproato em pacientes com distúrbios do ciclo da ureia31, um grupo de anormalidades genéticas incomuns, particularmente deficiência de ornitina-transcarbamilase. Antes de iniciar o tratamento com valproato, a avaliação com relação à presença de DCU deve ser considerada nos seguintes pacientes:
1) aqueles com história de encefalopatia55 inexplicável ou coma68, encefalopatia55 associada a sobrecarga proteica, encefalopatia55 relacionada com a gestação ou pós-parto, retardo mental inexplicável, ou história de amônia ou glutamina plasmáticas elevadas;
2) aqueles com vômitos53 cíclicos e letargia50, episódios de irritabilidade extrema, ataxia60, baixos níveis de nitrogênio de ureia31 sanguínea, evacuação proteica; 3) aqueles com história familiar de DCU ou história familiar de óbitos infantis inexplicáveis (particularmente meninos);
4) aqueles com outros sinais2 ou sintomas49 de DCU. Pacientes que desenvolverem sinais2 ou sintomas49 de encefalopatia55 hiperamonêmica inexplicável durante o tratamento com valproato devem ser tratados imediatamente (incluindo a interrupção do tratamento com valproato) e ser avaliados com relação à presença de um distúrbio do ciclo da ureia31 subjacente (ver “4. CONTRAINDICAÇÕES” e “5. ADVERTÊNCIAS E PRECAUÇÕES – Hiperamonemia e Encefalopatia55 associada ao uso concomitante de topiramato”).
Comportamento e ideação suicida: tem sido relatado um aumento no risco de pensamentos e comportamentos suicidas em pacientes que utilizam medicamentos antiepilépticos para qualquer indicação. O risco aumentado de comportamento ou pensamentos suicidas com medicamentos antiepilépticos foi observado logo uma semana após o início do tratamento medicamentoso com os antiepilépticos e persistiu durante todo o período em que o tratamento foi avaliado. O risco relativo de comportamento ou pensamentos suicidas foi maior em estudos clínicos para epilepsia3 do que em estudos para condições psiquiátricas ou outras, porém as diferenças com relação ao risco absoluto tanto para epilepsia3 quanto para indicações psiquiátricas foram similares. Pacientes tratados com um antiepiléptico para qualquer indicação devem ser monitorados para o aparecimento ou piora da depressão, comportamento ou pensamentos suicidas, e/ou qualquer mudança incomum de humor ou comportamento.
Qualquer um que leve em consideração a prescrição do divalproato de sódio ou qualquer outro antiepiléptico deve levar em conta, o risco de comportamento ou pensamentos suicidas com o risco da doença não tratada. Epilepsia3 e muitas outras doenças para as quais os antiepilépticos são prescritos estão associadas com morbidade69 e um aumento no risco de comportamento e pensamentos suicidas. Caso o comportamento e os pensamentos suicidas surjam durante o tratamento, o prescritor deve considerar se o aparecimento destes sintomas49 em qualquer paciente pode estar relacionado à doença que está sendo tratada. Pacientes, seus responsáveis e familiares devem ser informados que os antiepilépticos aumentam o risco de comportamento e pensamentos suicidas e aconselhados sobre a necessidade de estarem alerta para surgimento ou piora dos sinais2 e sintomas49 de depressão, qualquer mudança incomum de humor ou comportamento, ou o surgimento de comportamento e pensamentos suicidas ou pensamentos sobre automutilação. Comportamentos suspeitos devem ser informados imediatamente aos profissionais de saúde70.
Interação com antibióticos carbapenêmicos: antibióticos carbapenêmicos (ex. ertapenem, imipenem e meropenem) podem reduzir as concentrações séricas valproato a níveis subterapêuticos, resultando em perda de controle das crises. Os níveis séricos de valproato devem ser monitorados frequentemente após o início da terapia com carbapenêmicos. Tratamento alternativo com antibacterianos e anticonvulsivantes deve ser considerado se os níveis séricos de valproato tiverem queda significativa ou deterioração do controle das crises (ver “6. INTERAÇÕES MEDICAMENTOSAS – Antibióticos Carbapenêmicos”).
Trombocitopenia34: a frequência de efeitos adversos (particularmente enzimas hepáticas71 elevadas e trombocitopenia34) pode estar relacionada à dose. Em um estudo clínico de divalproato de sódio como monoterapia em pacientes com epilepsia3, 34/126 pacientes (27%) recebendo aproximadamente 50 mg/kg/dia, em média, apresentaram pelo menos um valor de plaquetas37 ≤ 75 x 109 /L. Aproximadamente metade desses pacientes tiveram o tratamento descontinuado, com retorno das contagens de plaquetas37 ao normal. Nos pacientes remanescentes, as contagens de plaquetas37 normalizaram-se mesmo com a continuação do tratamento. Neste estudo, a probabilidade de trombocitopenia34 pareceu aumentar significativamente em concentrações totais de valproato ≥ 110 mcg/mL (mulheres) ou ≥ 135 mcg/mL (homens). O benefício terapêutico que pode acompanhar as maiores doses deverá, portanto, ser considerado contra a possibilidade de maior incidência4 de eventos adversos.
Disfunção hepática25: ver “4. CONTRAINDICAÇÕES” e “5. ADVERTÊNCIAS E PRECAUÇÕES – Hepatoxicidade”.
Hiperamonemia: foi relatada hiperamonemia em associação com a terapia com valproato e pode estar presente apesar dos testes de função hepática25 normais. Em pacientes que desenvolvem letargia50 inexplicada e vômito72 ou mudanças no status mental, a encefalopatia55 hiperamonêmica deve ser considerada e o nível de amônia deve ser mensurado. Hiperamonemia também deve ser considerada em pacientes que apresentam hipotermia73 (ver “5. ADVERTÊNCIAS E PRECAUÇÕES - Hipotermia73”). Se a amônia estiver elevada, a terapia com valproato deve ser descontinuada. Intervenções apropriadas para o tratamento da hiperamonemia deve ser iniciada, e os pacientes devem ser submetidos a investigação para determinar as desordens do ciclo da ureia31 (ver “4. CONTRAINDICAÇÕES” e “5. ADVERTÊNCIAS E PRECAUÇÕES – Distúrbios do Ciclo da Ureia31 e Hiperamonemia e Encefalopatia55 associada ao uso concomitante de topiramato”).
Elevações assintomáticas de amônia são mais comuns, e quando presente, requerem monitoramento intensivo dos níveis de amônia no plasma17. Se a elevação persistir a descontinuação da terapia com valproato deve ser considerada.
Hiperamonemia e encefalopatia55 associadas com o uso concomitante de topiramato: a administração concomitante de topiramato e de ácido valproico foi associada com hiperamonemia, com ou sem encefalopatia55, nos pacientes que toleraram uma ou outra droga isoladamente. Os sintomas49 clínicos de encefalopatia55 por hiperamonemia incluem frequentemente alterações agudas no nível de consciência e/ou na função cognitiva74, com letargia50 ou vômitos53. Hipotermia73 também pode ser uma manifestação de hiperamonemia (ver “5. ADVERTÊNCIAS E PRECAUÇÕES - Hipotermia73”). Em muitos casos, os sintomas49 e sinais2 diminuem com a descontinuação de uma das drogas. Este evento adverso não está relacionado com uma interação farmacocinética. Não se sabe se a monoterapia com topiramato está associada a hiperamonemia.
Pacientes com erros inatos do metabolismo18 ou atividade mitocondrial hepática25 reduzida podem apresentar risco aumentado para hiperamonemia, com ou sem encefalopatia55. Embora não estudada, a interação de topiramato e ácido valproico pode exacerbar defeitos existentes ou revelar deficiências em pessoas suscetíveis (ver “4. CONTRAINDICAÇÕES” e “5. ADVERTÊNCIAS E PRECAUÇÕES – Desordens do Ciclo da Ureia31 e Hiperamonemia”).
Pacientes e responsáveis devem ser informados sobre os sinais2 e sintomas49 associados à encefalopatia55 hiperamonêmica, requerendo avaliação médica se esses sintomas49 ocorrerem.
Hipotermia73: definida como uma queda da temperatura central do corpo para menos de 35ºC tem sido relatada em associação com a terapia com valproato em conjunto e na ausência de hiperamonemia. Esta reação adversa também pode ocorrer em pacientes utilizando topiramato e valproato concomitantes após o início do tratamento com topiramato ou após o aumento da dose diária de topiramato (ver “6. INTERAÇÕES MEDICAMENTOSAS – Topiramato” e “5. ADVERTÊNCIAS E PRECAUÇÕES – Hiperamonemia e Encefalopatia55 associadas ao uso concomitante de topiramato”). Deve ser considerada a interrupção do valproato em pacientes que desenvolverem hipotermia73, a qual pode se manifestar por uma variedade de anormalidades clínicas incluindo letargia50, confusão, coma68 e alterações significativas em outros sistemas importantes como o cardiovascular e o respiratório. Monitoração e avaliação clínica devem incluir análise dos níveis de amônia no sangue7.
Atrofia75 Cerebral/Cerebelar: houve relatos pós-comercialização de atrofia75 (reversível e irreversível) cerebral e cerebelar, temporariamente associadas ao uso de produtos que se dissociam em íon8 valproato. Em alguns casos, porém, a recuperação foi acompanhada por sequelas76 permanentes. Foi observado prejuízo psicomotor77 e atraso no desenvolvimento em crianças com atrofia75 cerebral decorrente da exposição ao valproato quando em ambiente intrauterino. As funções motoras e cognitivas dos pacientes devem ser monitoradas rotineiramente e o medicamento deve ser descontinuado nos casos de suspeita ou de aparecimento de sinais2 de atrofia75 cerebral.
Reação de hipersensibilidade de múltiplos órgãos: foram raramente relatadas com associação temporal próxima após o início da terapia com o valproato em adultos e em pacientes pediátricos (tempo médio para detecção de 21 dias, variando de 1 a 40). Embora houvesse um número limitado de relatos, muitos destes casos resultaram em hospitalização e pelo menos, uma morte foi relatada. Os sinais2 e os sintomas49 deste distúrbio eram diversos; entretanto, os pacientes tipicamente, embora não exclusivamente, apresentaram febre78 e erupções cutâneas79, com envolvimento de outros órgãos do sistema. Outras manifestações associadas podem incluir linfadenopatia, hepatite23, anormalidade de testes de função do fígado19, anormalidades hematológicas (por exemplo, eosinofilia80, trombocitopenia34, neutropenia81), prurido82, nefrite83, oligúria84, síndrome30 hepatorrenal, artralgia85 e astenia86. Como o distúrbio é variável em sua expressão, sinais2 e sintomas49 de outros órgãos não relacionados aqui podem ocorrer. Se houver suspeita desta reação, o valproato deve ser interrompido e um tratamento alternativo ser iniciado. Embora a existência de sensibilidade cruzada com outras drogas que produzem esta síndrome30 não seja clara, a experiência com drogas associadas a hipersensibilidade de múltiplos órgãos indicaria que isso é possível.
Este medicamento contém 141mg de hidróxido de sódio por dose. Esta informação deve ser considerada por pacientes com um controle do sódio.
Carcinogênese
Observou-se uma variedade de neoplasmas87 em ratos Sprague-Dawley e camundongos ICR (HA/ICR) recebendo ácido valproico oralmente em doses de 80 e 170 mg/kg/dia, por dois anos (aproximadamente 10% a 50 % da dose diária humana máxima, em mg/m2). Os principais achados foram um aumento estatisticamente significante na incidência4 de fibrossarcomas subcutâneos em ratos machos recebendo altas doses de ácido valproico e de adenomas pulmonares benignos relacionado à dose, em camundongos machos recebendo ácido valproico. O significado desses achados para humanos não é conhecido até o momento.
Mutagênese
Estudos com valproato, usando sistemas bacterianos “in vitro” (teste de AMES) não evidenciaram potencial mutagênico, efeitos letais dominantes em camundongos, nem aumento na frequência de aberrações cromossômicas (SCE) em um estudo citogenético “in vivo” em ratos. Aumento na frequência de alterações nas cromátides irmãs foi relatado em um estudo de crianças epilépticas recebendo valproato, mas esta associação não foi observada em estudos conduzidos com adultos. Houve algumas evidências de que a frequência de SCE poderia estar associada com epilepsia3. O significado biológico desse aumento não é conhecido.
Fertilidade
Estudos de toxicidade88 crônica em ratos jovens e adultos e em cães demonstraram redução da espermatogênese e atrofia75 testicular com doses orais de 400 mg/kg/dia ou mais em ratos (aproximadamente equivalente a ou maior do que a dose diária máxima em humanos na base de mg/m2) e 150 mg/kg/dia ou mais em cães (aproximadamente 1,4 vezes a dose diária máxima em humanos na base de mg/m2). Estudos de fertilidade de segmento em ratos mostraram que doses orais de até 350 mg/kg/dia (aproximadamente igual à dose máxima diária em humanos na base de mg/m2) durante 60 dias não afetaram a fertilidade. O efeito do valproato no desenvolvimento testicular e na produção espermática de fertilidade em humanos não é conhecido.
Cuidados e advertências para populações especiais
Uso em idosos: não foram avaliados pacientes com mais de 65 anos nos ensaios clínicos6 duplo-cegos prospectivos de mania associada com transtorno bipolar. Em um estudo de revisão de caso de 583 pacientes, 72 pacientes (12%) apresentavam idade superior a 65 anos. Uma alta porcentagem de pacientes acima de 65 anos de idade relatou ferimentos acidentais, infecção89, dor, sonolência e tremor. A descontinuação de valproato foi ocasionalmente associada com os dois últimos eventos. Não está claro se esses eventos indicam riscos adicionais ou se resultam de doenças pré-existentes e uso de medicamentos concomitantes por estes pacientes. Não existe informação suficiente disponível para discernir sobre a segurança e eficácia de divalproato de sódio para a profilaxia de enxaquecas90 em pacientes acima de 65 anos.
Em um estudo duplo-cego91, multicêntrico com valproato em pacientes idosos com demência92 (idade média=83 anos de idade), as doses foram aumentadas em 125 mg/dia para uma dose alvo de 20 mg/kg/dia. Uma proporção significativamente mais alta de pacientes que receberam valproato apresentou sonolência, comparados ao placebo5 e embora não estatisticamente significante, houve maior proporção de pacientes com desidratação93. Descontinuações devidas à sonolência foram também significativamente mais altas do que com placebo5. Em alguns pacientes com sonolência (aproximadamente a metade), houve consumo nutricional reduzido associado e perda de peso. Houve uma tendência dos pacientes que apresentaram esses eventos de ter menor concentração basal de albumina24, menor depuração de valproato e maior ureia31 sanguínea.
Em pacientes idosos, a dosagem deve ser aumentada mais lentamente, com monitorização regular do consumo de líquidos e alimentos, desidratação93, sonolência e outros eventos adversos. Reduções de dose ou descontinuação do valproato devem ser consideradas em pacientes com menor consumo de líquidos ou alimentos e em pacientes com sonolência excessiva. A dose inicial deverá ser reduzida nestes pacientes e reduções de dosagem ou descontinuação deverão ser consideradas para pacientes1 com sonolência excessiva.
Uso pediátrico: a experiência indicou que crianças com idade inferior a dois anos têm um aumento de risco considerável de desenvolvimento de hepatotoxicidade46 fatal e esse risco diminui progressivamente em pacientes mais velhos. Neste grupo de pacientes, o divalproato de sódio deverá ser usado como agente único, com extrema cautela, devendo-se avaliar cuidadosamente os riscos e benefícios do tratamento. Acima de dois anos, experiência em epilepsia3 indicou que a incidência4 de hepatotoxicidade46 fatal diminui consideravelmente em grupo de pacientes progressivamente mais velhos. Crianças jovens, especialmente aquelas que estejam recebendo medicamentos indutores de enzimas, irão requerer doses de manutenção maiores para alcançar as concentrações de ácido valproico não ligado e total desejados. A variabilidade das frações livres limita a utilidade clínica de monitorização das concentrações totais plasmáticas de ácido valproico. A interpretação das concentrações de ácido valproico em crianças deverá levar em consideração os fatores que afetam o metabolismo18 hepático e ligação às proteínas13. A segurança e a eficácia do divalproato de sódio para o tratamento de mania aguda não foram estudadas em indivíduos abaixo de 18 anos de idade, bem como também não foram avaliadas para a profilaxia da enxaqueca33 em indivíduos abaixo de 16 anos de idade. A toxicologia básica e as manifestações patológicas do valproato de sódio em ratos no período neonatal (quatro dias de vida) e juvenil (14 dias de vida) são semelhantes àquelas observadas em ratos adultos jovens. Entretanto, foram observados achados adicionais, incluindo alterações renais em ratos juvenis e alterações renais e displasia94 retiniana em ratos recém-nascidos. Esses achados ocorreram com a dose de 240 mg/kg/dia, uma dose aproximadamente equivalente à dose diária máxima recomendada em humanos na base de mg/m2. Eles não foram encontrados com a dose de 90 mg/kg, ou 40% da dose diária máxima humana na base de mg/m2.
Mulheres com potencial para engravidar: Devido ao risco para o feto95 de malformação96 congênita97 maior (incluindo defeito no tubo neural98), o ácido valproico deve ser considerado para mulheres com potencial para engravidar somente depois que os riscos forem discutidos extensamente com a paciente e pesados com os benefícios potenciais do tratamento.
Isto é especialmente importante quando o uso de ácido valproico é considerado para condições não associadas geralmente com dano permanente ou morte (por exemplo, migrânea61).
Mulheres com potencial para engravidar devem usar contraceptivos efetivos enquanto usam ácido valproico.
Uso durante a gravidez99 e lactação100: Como o ácido valproico tem sido associado com certos tipos de defeitos no nascimento, pacientes mulheres em idade fértil devem ser alertadas dos riscos associados ao uso de ácido valproico durante a gravidez99. O ácido valproico é contraindicado durante a gravidez99 para mulheres tratadas para profilaxia de migrânea61.
Mulheres que sofrem de epilepsia3 ou desordem bipolar que estão grávidas ou que planejam engravidar não devem ser tratadas com ácido valproico a não ser que outros tratamentos tenham falhado no controle adequado dos sintomas49 ou são de outra forma, inaceitáveis. Nessas mulheres, o benefício do tratamento com ácido valproico durante a gravidez99 pode superar os riscos.
Medicamentos antiepilépticos não devem ser descontinuados bruscamente em pacientes nos quais o medicamento é administrado para impedir convulsões maiores, pois existe grande possibilidade de desencadeamento de estado de mal epiléptico com hipóxia101 contínua e risco à vida. Em casos individuais nas quais a severidade e frequência das convulsões são tais que a retirada do medicamento não representa uma séria ameaça para o paciente, a descontinuação da droga pode ser considerada antes e durante a gravidez99. No entanto, não se pode dizer com segurança que mesmo pequenas convulsões não apresentam alguns riscos para o desenvolvimento do embrião ou feto95.
Risco associado ao ácido valproico
Humanos: relatos publicados e não publicados indicaram que o ácido valproico pode produzir efeitos teratogênicos102, tais como defeitos no tubo neural98 (exemplo, espinha bífida103) nos fetos de mulheres tomando o medicamento durante a gravidez99. Há dados que sugerem uma incidência4 aumentada de malformações104 congênitas54 associadas com o uso do ácido valproico durante a gravidez99, quando comparada com algumas outras drogas antiepilépticas. Consequentemente, o ácido valproico deve ser considerado para mulheres com potencial para engravidar somente depois que os riscos forem discutidos extensamente com a paciente e pesados de encontro aos benefícios potenciais do tratamento.
Há múltiplos relatos na literatura clínica que indicam que o uso de medicamentos anticonvulsivantes em geral, durante a gravidez99, resulta em um aumento da incidência4 de defeitos congênitos105 no feto95. Portanto, os anticonvulsivantes só devem ser administrados a mulheres com potencial para engravidar se demonstrarem claramente serem essenciais no tratamento de suas crises convulsivas. Os dados descritos abaixo foram obtidos quase que exclusivamente de mulheres que receberam valproato para tratar a epilepsia3. A incidência4 de defeitos no tubo neural98 no feto95 pode ser aumentada em gestantes que receberem valproato durante o primeiro trimestre da gravidez99. Centros de controle de doenças (CDC) dos Estados Unidos estimaram em aproximadamente 1 a 2% o risco de crianças nascidas de mulheres expostas ao ácido valproico apresentarem espinha bífida103.
Outras anomalias congênitas54 (defeitos craniofaciais, malformações104 cardiovasculares, hipospadias e anormalidades envolvendo vários sistemas corporais), compatíveis ou incompatíveis com a vida, foram relatadas. Dados de uma meta-análise (incluindo relatos e estudos de coorte106) mostraram um aumento da incidência4 de más-formações em crianças nascidas de mães expostas à monoterapia com valproato durante a gravidez99. Os dados disponíveis indicam que este efeito é dose-dependente.
O ácido valproico pode causar decréscimo no QI107 após exposição ao valproato quando em ambiente intrauterino. Estudos epidemiológicos publicados têm indicado que crianças expostas à valproato em ambiente intrauterino têm pontuações menores no teste cognitivo108 do que crianças expostas em ambiente intrauterino a outro antiepiléptico ou não exposto a antiepilético. Um estudo de coorte109 prospectivo110 realizado nos Estados Unidos e Reino Unido com crianças de 6 anos de idade mostrou que a exposição fetal ao valproato tem relação dose-dependentes com capacidades cognitivas reduzidas comparados a outros antiepiléptico em monoterapia. Houve relatos de atraso de desenvolvimento, autismo e/ou transtornos do espectro do autismo nos filhos das mulheres expostas ao ácido valproico durante a gravidez99.
A exposição intrauterina ao valproato foi associada à atrofia75 cerebral com variados níveis/manifestações do comprometimento neurológico, incluindo retardo do desenvolvimento e prejuízo psicomotor77 (ver “9. REAÇÕES ADVERSAS” e “5. ADVERTÊNCIA E PRECAUÇÕES”).
Animais: estudos em animais demonstram teratogenicidade induzida por valproato. Foi observado em camundongos, ratos, coelhos e macacos, frequências aumentadas de malformações104, bem como de atraso do crescimento intrauterino e óbito65, após exposição pré-natal ao valproato. Malformações104 do sistema esquelético111 são as anomalias estruturais mais comumente produzidas em animais de experimentação, mas os defeitos do fechamento do tubo neural98 foram observados em camundongos expostos a concentrações de valproato no plasma17 materno acima de 230 mcg/mL (2,3 vezes maior que o limite superior de doses recomendadas a humanos) durante períodos suscetíveis de desenvolvimento embrionário. A administração de uma dose oral de 200 mg/kg/dia ou mais (50% da dose diária máxima humana, ou maior na base de mg/m 2) a ratas prenhas durante a organogênese produziu malformações104 (esqueleto112, coração113 e urogenitais) e atraso no crescimento das crias. Essas doses resultaram em níveis plasmáticos de picos maternos de aproximadamente 340 mcg/mL ou mais (3,4 vezes o limite superior da variação terapêutica114 em humanos, ou mais). Nas crias de ratas recebendo dose de 200 mg/kg/dia durante quase toda a gravidez99, foram relatadas alterações do comportamento. Uma dose oral de 350 mg/kg/dia (duas vezes a dose diária máxima humana na base de mg/m2) produziu malformações104 no esqueleto112 e vísceras em coelhos expostos durante a organogênese. Após administração de uma dose oral de 200 mg/kg/dia (igual à dose diária máxima humana na base de mg/m2) durante a organogênese, foram observadas malformações104 esqueléticas, atraso do crescimento e óbito65, em macacos rhesus. Esta dose resultou em níveis plasmáticos maternos de pico de aproximadamente 280 mcg/mL (2,8 vezes maior que o limite superior da variação terapêutica114 humana).
Riscos para neonatos21: grávidas recebendo valproato podem desenvolver anormalidades de coagulação35, incluindo trombocitopenia34, hipofibrinogenemia e/ou diminuição dos fatores de coagulação35, que pode resultar em complicações hemorrágicas115 no neonato116 incluindo morte. Os parâmetros de coagulação35 deverão ser monitorizados cuidadosamente.
Insuficiência hepática47 resultando em morte de um recém-nascido e de um lactente117 foram relatadas após o uso de valproato durante a gravidez99.
Houve relatos de hipoglicemia118 em neonatos21 cujas mães receberam valproato durante a gestação.
Casos de hipotireoidismo119 foram reportados em neonatos21 cujas mães receberam valproato durante a gestação.
A síndrome30 de abstinência (como, em particular, agitação, irritabilidade, hiperexcitabilidade, inquietação motora, hipercinesia120, distúrbios de tonicidade, tremores, convulsões e desordens alimentares) podem ocorrer em neonatos21 cujas mães tomaram valproato durante o último trimestre de gestação.
Testes para detectar defeitos do tubo neural98 e outros usando procedimentos atualmente aceitos deverão ser considerados como parte da rotina pré-natal em mulheres em idade fértil recebendo valproato.
Lactação100: o valproato é excretado no leite materno. As concentrações no leite materno foram relatadas como sendo de 1% a 10% das concentrações séricas. Não se sabe qual efeito isto teria sobre um bebê lactente121. Deve-se levar em consideração a interrupção da amamentação122 quando o divalproato de sódio for administrado a uma mulher lactante123.
Categoria de risco: D
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica. Informe imediatamente seu médico em caso de suspeita de gravidez99.
Capacidade de dirigir veículos e operar máquinas: como o divalproato de sódio pode produzir depressão no sistema nervoso central124 (SNC16), especialmente quando combinado com outro depressor do SNC16 (por exemplo: álcool), pacientes devem ser aconselhados a não se ocupar de atividades perigosas, como dirigir automóveis ou operar maquinário perigoso, até que se saiba se o paciente não teve sonolência com o uso da droga.
- 6. INTERAÇÕES MEDICAMENTOSAS
Efeitos de medicamentos coadministrados na depuração do valproato
Os medicamentos que afetam o nível de expressão das enzimas hepáticas71, particularmente aqueles que elevam os níveis das glicuroniltransferases (tais como ritonavir), podem aumentar a depuração de valproato. Por exemplo, fenitoína, carbamazepina e fenobarbital (ou primidona) podem duplicar a depuração de valproato. Assim, pacientes em monoterapia geralmente apresentarão meias-vidas maiores e concentrações mais altas do que pacientes recebendo politerapia com medicamentos antiepilépticos. Em contraste, medicamentos inibidores das isoenzimas do citocromo P450, como por exemplo os antidepressivos, deverão ter pouco efeito sobre a depuração do valproato, porque a oxidação mediada por microssomos do citocromo P450 é uma via metabólica secundária relativamente não importante, comparada à glicuronidação e beta-oxidação. Devido a essas alterações na depuração de valproato, a monitorização de suas concentrações e de medicamentos concomitantes deverá ser intensificada sempre que medicamentos indutores de enzimas forem introduzidos ou retirados. A lista seguinte fornece informações sobre o potencial ou a influência de uma série de medicamentos comumente prescritos sobre a farmacocinética do valproato até o momento reportados.
Medicamentos com importante potencial de interação
ácido acetilsalicílico: um estudo envolvendo a coadministração de ácido acetilsalicílico em doses antipiréticas (11 a 16 mg/kg) a pacientes pediátricos (n=6) revelou um decréscimo na proteína ligada e uma inibição do metabolismo18 do valproato. A fração livre de valproato aumenta quatro vezes na presença de ácido acetilsalicílico, quando comparada com o valproato, administrado como monoterapia. A via da β-oxidação consistindo de 2-E-ácido valproico, 3-OH-ácido valproico, e 3-ceto ácido valproico foi diminuída de 25% do total de metabólitos125 excretados quando o valproato foi administrado sozinho, para 8,3% quando na presença de ácido acetilsalicílico. Cuidados devem ser observados se valproato e ácido acetilsalicílico forem administrados concomitantemente.
antibióticos carbapenêmicos: uma redução clínica significante na concentração sérica de ácido valproico foi relatada em pacientes recebendo antibióticos carbapenêmicos (ex. ertapenem, imipenem e meropenem) e pode resultar na perda de controle das crises. O mecanismo desta interação ainda não é bem compreendido. As concentrações séricas de ácido valproico devem ser monitoradas frequentemente após o início da terapia carbapenêmica. Terapias antibacterianas ou anticonvulsivantes alternativas devem ser consideradas, caso a concentração sérica de ácido valproico caia significativamente ou haja piora no controle das crises (ver “5. ADVERTÊNCIAS E PRECAUÇÕES – Interações com antibióticos carbapenêmicos”).
felbamato: um estudo envolvendo a coadministração de 1200 mg/dia de felbamato com valproato em pacientes com epilepsia3 (n=10) revelou um aumento no pico de concentração média de valproato de 35% (de 86 a 115 mcg/mL) comparado com a administração isolada de valproato. O aumento da dose de felbamato para 2400 mg/dia aumentou o pico de concentração média do valproato para 133 mcg/mL (aumento adicional de 16%). Uma diminuição na dosagem de valproato pode ser necessária quando a terapia com felbamato for iniciada.
rifampicina: um estudo de coadministração de dose única de valproato (7 mg/kg), 36 horas após uso diário de rifampicina (600 mg) por cinco noites consecutivas, revelou aumento de 40% na depuração de valproato oral. Neste caso, a dose de valproato deve ser ajustada, quando necessário.
Medicamentos para os quais não foi detectada nenhuma interação ou com interação sem relevância clínica
antiácidos126: um estudo envolvendo a coadministração de 500 mg de valproato com antiácidos126 comumente usados (ex: hidróxidos de magnésio e alumínio em doses de 160 mEq) não revelou efeito na extensão da absorção do valproato.
clorpromazina: um estudo envolvendo a administração de 100 a 300 mg/dia de clorpromazina a pacientes esquizofrênicos que já estavam recebendo valproato (200 mg, duas vezes ao dia) revelou um aumento de 15% dos níveis plasmáticos do valproato.
haloperidol: um estudo envolvendo a administração de 6 a 10 mg/dia de haloperidol a pacientes esquizofrênicos já recebendo valproato (200 mg, duas vezes ao dia) não revelou alterações significativas nos níveis plasmáticos mais baixos de valproato.
cimetidina e ranitidina: não alteram a depuração do valproato.
Efeitos do valproato em outros medicamentos
O valproato é um fraco inibidor de algumas isoenzimas do sistema citocromo P450, epoxidrase e glucuroniltransferase. A lista seguinte fornece informações a respeito da potencial influência do valproato sobre a farmacocinética ou farmacodinâmica de medicamentos mais comumente prescritos. Esta lista não é definitiva uma vez que novas interações são continuamente relatadas.
Medicamentos com importante potencial de interação
amitriptilina/nortriptilina: a administração de uma dose única oral de 50 mg de amitriptilina a 15 voluntários sadios (10 homens e 5 mulheres) que receberam valproato (500 mg duas vezes ao dia), resultou numa diminuição de 21% na depuração plasmática da amitriptilina e de 34% na depuração total da nortriptilina. Há relatos raros de uso concomitante do valproato e da amitriptilina que resultaram em aumento do nível da amitriptilina. O uso concomitante de valproato e amitriptilina raramente foi associado com toxicidade88. A monitoração dos níveis de amitriptilina deve ser considerada para pacientes1 recebendo valproato concomitantemente com amitriptilina. Deve-se considerar a diminuição da dose de amitriptilina/nortriptilina na presença de valproato.
carbamazepina (CBZ)/carbamazepina-10,11-epóxido (CBZ-E): os níveis séricos de CBZ diminuíram 17% enquanto que os de CBZ-E aumentaram em torno de 45% na coadministração de valproato e CBZ em pacientes epilépticos.
clonazepam: o uso concomitante de ácido valproico e de clonazepam pode induzir estado de ausência em pacientes com história desse tipo de crises convulsivas.
diazepam: o valproato desloca o diazepam de seus locais de ligação à albumina24 plasmática e inibe seu metabolismo18. A coadministração de valproato (1500 mg diariamente) aumentou a fração livre de diazepam (10 mg) em 90% em voluntários sadios (n=6). A depuração plasmática e o volume de distribuição do diazepam livre foram reduzidos em 25% e 20%, respectivamente, na presença de valproato. A meia-vida de eliminação do diazepam permaneceu inalterada com a adição de valproato.
etossuximida: o valproato inibe o metabolismo18 de etossuximida. A administração de uma dose única de etossuximida de 500 mg com valproato (800 a 1600 mg/dia) a voluntários sadios, foi acompanhada por um aumento de 25% na meia-vida de eliminação da etossuximida e um decréscimo de 15% na sua depuração total quando comparado a etossuximida administrada como monoterapia. Pacientes recebendo valproato e etossuximida, especialmente em conjunto com outros anticonvulsivantes, devem ser monitorados em relação às alterações das concentrações séricas de ambas as substâncias.
lamotrigina: em um estudo envolvendo dez voluntários sadios, a meia-vida de eliminação da lamotrigina no estado de equilíbrio aumentou de 26 para 70 horas quando administrada em conjunto com valproato (aumento de 165%). Portanto, a dose de lamotrigina deverá ser reduzida nesses casos. Reações graves de pele127 (como síndrome de Stevens-Johnson128 e necrólise epidérmica tóxica129) foram relatadas com o uso concomitante de lamotrigina e valproato. Verificar a bula de lamotrigina para obter informações sobre a dosagem de lamotrigina em casos de administração concomitante com valproato.
fenobarbital: o valproato inibe o metabolismo18 do fenobarbital. A coadministração de valproato (250 mg duas vezes ao dia por 14 dias) com fenobarbital a indivíduos normais (n=6) resultou num aumento de 50% na meia-vida e numa redução de 30% na depuração plasmática do fenobarbital (dose única 60 mg). A fração da dose de fenobarbital excretada inalterada aumentou 50% na presença de valproato. Há evidências de depressão grave do SNC16, com ou sem elevações significativas das concentrações séricas de barbiturato ou de valproato. Todos os pacientes recebendo tratamento concomitante com barbiturato devem ser cuidadosamente monitorados quanto à toxicidade88 neurológica. Se possível, as concentrações séricas de barbituratos deverão ser determinadas e a dosagem deverá ser reduzida, quando necessário.
primidona: é metabolizada em barbiturato e portanto pode também estar envolvida em interação semelhante à do valproato com fenobarbital.
fenitoína: o valproato desloca a fenitoína de sua ligação com a albumina24 plasmática e inibe seu metabolismo18 hepático. A coadministração de valproato (400 mg, 3 vezes ao dia) e fenitoína (250 mg), em voluntários sadios (n=7), foi associada com aumento de 60% na fração livre de fenitoína. A depuração plasmática total e o volume aparente de distribuição da fenitoína aumentaram em 30% na presença de valproato. Há relatos de desencadeamento de crises com a combinação de valproato e fenitoína em pacientes com epilepsia3. Se necessário, deve-se ajustar a dose de fenitoína de acordo com a situação clínica.
tolbutamida: em experimentos “in vitro”, a fração livre de tolbutamida foi aumentada de 20% para 50% quando adicionada em amostras plasmáticas de pacientes tratados com valproato. A relevância clínica desse fato é desconhecida.
topiramato: administração concomitante do ácido valproico e do topiramato foi associada com hiperamonemia, com ou sem encefalopatia55 (ver “4. CONTRAINDICAÇÕES” e “5. ADVERTÊNCIAS E PRECAUÇÕES – Distúrbios do Ciclo da Ureia31 e Hiperamonemia e Encefalopatia55 associada ao uso concomitante de topiramato”). A administração concomitante de topiramato com ácido valproico também foi associada com hipotermia73 em pacientes que já haviam tolerado cada medicamento sozinho. O nível sanguíneo de amônia deve ser mensurado em pacientes com relatado início de hipotermia73 (ver “5. ADVERTÊNCIAS E PRECAUÇÕES – Hipotermia73 e Hiperamonemia”).
varfarina: em um estudo “in vitro”, o valproato aumentou a fração não ligada de varfarina em até 32,6%. A relevância terapêutica114 deste achado é desconhecida; entretanto, testes para monitorização de coagulação35 deverão ser realizados se o tratamento com divalproato de sódio for instituído em pacientes tomando anticoagulantes130.
zidovudina: em 6 pacientes soropositivos para HIV44, a depuração da zidovudina (100 mg a cada 8 horas) diminuiu em 38% após a administração de valproato (250 ou 500 mg a cada 8 horas); a meia-vida da zidovudina ficou inalterada.
quetiapina: a co-administração de valproato e quetiapina pode aumentar o risco de neutropenia81/leucopenia131.
Medicamentos para os quais não foi detectada nenhuma interação ou com interação sem relevância clínica
paracetamol: o valproato não apresentou nenhum efeito nos parâmetros farmacocinéticos do paracetamol quando administrado concomitantemente à três pacientes com epilepsia3.
clozapina: em pacientes psicóticos (n=11), não foram observadas interações quando o valproato foi administrado concomitantemente com clozapina.
lítio: a co-administração de valproato (500 mg duas vezes ao dia) e lítio (300 mg três vezes ao dia) a voluntários sadios do sexo masculino (n=16) não apresentou efeitos no estado de equilíbrio cinético do lítio.
lorazepam: a administração de lorazepam (1 mg, uma vez ao dia) concomitante com valproato (500 mg , duas vezes ao dia) em voluntários homens sadios (n=9) foi acompanhada por uma diminuição de 17% na depuração plasmática do lorazepam.
olanzapina: administração de dose única de olanzapina a 10 voluntários saudáveis com divalproato de sódio em comprimidos revestidos de liberação prolongada (1000 mg quatro vezes ao dia) não produziu alterações na Cmáx e na meia-vida de eliminação de olanzapina. Entretanto, a ASC de olanzapina se apresentou 35% menor na presença de divalproato de sódio em comprimidos revestidos de liberação prolongada. A relevância clínica destas observações é desconhecida.
contraceptivos orais esteroidais: a administração de uma dose única de etinilestradiol (50 mcg) e levonorgestrel (250 mcg) em 6 mulheres em tratamento com valproato (200 mg, duas vezes ao dia) por 2 meses, não revelou qualquer interação farmacocinética.