
INDICAÇÕES KLARICID SUSPENSÃO
KLARICID (claritromicina) é destinado ao tratamento de infecções1 das vias aéreas superiores e inferiores e infecções1 de pele2 e tecidos moles causadas por todos os micro-organismos sensíveis a claritromicina. KLARICID também é destinado para o tratamento de infecções1 disseminadas ou localizadas produzidas por Mycobacterium avium ou Mycobacterium intracellulare, e infecções1 localizadas causadas por Mycobacterium chelonae, Mycobacterium fortuitum ou Mycobacterium kansasii.
- 2. RESULTADOS DE EFICÁCIA
Na otite média3 aguda
A claritromicina é efetiva contra os principais patógenos responsáveis pela otite média3. Ela apresenta altas concentrações nos fluidos do ouvido médio4, não é afetado pelas betalactamases e não induz a produção de betalactamases. Dois estudos randomizados compararam a claritromicina suspensão com outros antibióticos. O primeiro estudo randomizado5 mono cego comparou a eficácia de claritromicina suspensão (7,5 mg/kg duas vezes ao dia) e cefuroxima axetil (10 a 15 mg duas vezes ao dia) por 7 dias em crianças. O sucesso clínico foi observado em 96% do grupo claritromicina suspensão versus 94% do grupo cefuroxima acetil. A claritromicina
foi altamente efetiva e bem tolerada no tratamento de otite média3 em crianças e comparável a cefuroxima acetil durante 7 dias. O segundo estudo randomizado5 monocego comparou a eficácia de claritromicina suspensão e amoxicilina clavulanato no tratamento da otite média3 aguda em crianças. A cura clínica foi observada em 90% do grupo claritromicina e 92% do grupo amoxicilina clavulanato (p=0,681). A diarreia6 ocorreu em 12% do grupo claritromicina e 32% do grupo amoxicilina clavulanato (p<0,001). Os autores concluíram que a claritromicina suspensão oral é comparável a amoxicilina clavulanato no tratamento da otite média3 aguda em crianças, e melhor tolerada devido a menor incidência7 de eventos adversos gastrointestinais.
Faringoamigdalite por Streptococcus
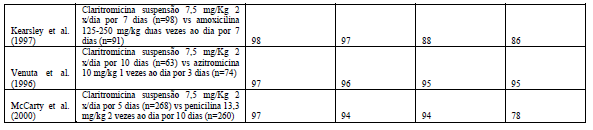
A erradicação bacteriológica é o objetivo primário do tratamento da faringoamigdalite. Os estudos apresentados na Tabela abaixo evidenciaram que a taxa erradicação bacteriológica ocorreu 88 a 95% e foi similar ou estatisticamente superior as drogas comparativas (penicilina oral, azitromicina, amoxicilina).

Outras infecções1
A claritromicina também está indicada para sinusite8 aguda, infecções1 de pele2 e tecidos moles, pneumonia9 e infecções1 por micobactérias disseminadas e comparada a eritromicina acarreta menor incidência7 de eventos adversos gastrointestinais, menor taxa de descontinuação de tratamento causada pelos efeitos adversos e menor potencial de interação medicamentosa. No tratamento da infecção10 por Helicobacter pylori é uma das drogas que compõe o esquema clássico (inibidor de bomba-amoxicilina-claritromicina) ou quádruplo (associado a bismuto).
Referências Bibliográficas
• Aspin MM, Hoberman A, McCarty J, McLinn SE, Aronoff S, Lang DJ, Arrieta A, et al. “Comparative study of the safety and efficacy of clarithromycin and amoxicillin-clavulanate in the treatment of acute otitis media in children”: J Pediatr. 1994, 125(1):136-41.
• Anzueto A, Norris S, et al. “Clarithromycin in 2003: sustained efficacy and safety in an era of rising antibiotic resistance”: Int J Antimicrob Agents. 2004, 24(1):1-17.
• Baquero-Artigao F. “Pediatric infections caused by nontuberculous mycobacteria”: An Pediatr (Barc). 2005, 62(5): 458-66.
• Kafetzis DA et al. “Comparation of efficacy and tolerability of clarithromycin suspension and cefuroxime in the treatment of acute otitis media in pediatric patients”: Clin Drug Invest. 1997; 14(3): 192-99.
• Kearsley NL, Campbell A, Sanderson AA, Weir RD, Kamdar MK, Coles SJ. et al. “Comparison of clarithromycin suspension and amoxicillin syrup for the treatment of children pharyngitis and/or tonsillitis”: Br J Clin Pract. 1997, 51:133–7.
• Klein JO. “History of macrolide use in pediatrics”: Pediatr Infect Dis J. 1997; 16(4): 427-31.
• McCarty J, Hedrick JA, Gooch WM. et al. “Clarithromycin suspension vs. penicillin V suspension in children with streptococcal pharyngitis”. Adv Ther. 2000, 17:14–26.
• Songur Y, Senol A, Balkarli A, Cerci S. et al. “Triple or quadruple tetracycline basead therapies versus standard triple treatment for Helicobacter pylori treatment”. Am J Med Sci. 2009; 338(1): 50-3.
• Still JG, Hubbard WC, Poole JM, Sheaffer CI, Chartrand S, Jacobs R et al. “Comparison of clarithromycin and penicillin VK suspensions in the treatment of children with streptococcal pharyngitis and review of currently available alternative antibiotic therapies”. Pediatr Infect Dis J. 1993;12 (Suppl 3):S134–41.
• Venuta A, Laudizi L, Beverelli A, Bettelli F, Milioli S, Garetti E et al. “Azithromycin compared with clarithromycin for the treatment of streptococcal pharyngitis in children”. J Int Med Res. 1998; 26:152–8.
- 3. CARACTERÍSTICAS FARMACOLÓGICAS
Claritromicina é um antibiótico macrolídeo semi-sintético obtido pela substituição do grupo CH3O pelo hidroxilo (OH) na posição 6 do anel lactônico da eritromicina. Especialmente para a claritromicina é a 6-O-metil-eritromicina. A claritromicina é um pó branco ou esbranquiçado, amargo e praticamente sem cheiro, insolúvel em água, levemente solúvel em metanol, etanol e acetonitrila, e praticamente insolúvel em água. O peso molecular é 747,96.
Microbiologia
A claritromicina exerce sua ação antibacteriana através de sua ligação às subunidades ribossômicas 50S dos agentes patogênicos sensíveis, suprimindo-lhes a síntese proteica.
A claritromicina apresenta excelente atividade in vitro tanto contra cepas11 padronizadas de bactérias quanto contra bactérias isoladas na clínica. A claritromicina é altamente potente contra uma grande variedade de organismos Gram-positivos e Gram-negativos aeróbios e anaeróbios. As concentrações inibitórias mínimas (CIMs) da claritromicina geralmente são uma diluição log2 mais potente do que as CIMs da eritromicina.
Os dados in vitro também indicam que a claritromicina apresenta uma excelente atividade contra Legionella pneumophilia, Mycoplasma pneumoniae e Helicobacter pylori. Esta atividade é maior em pH neutro do que em pH ácido. Dados in vitro e in vivo mostram que este antibiótico apresenta atividade contra espécies de micobactérias clinicamente significativa. Os dados in vitro indicam que espécies de Enterobacteriaceae e de pseudomonas e outros bacilos Gram-negativos não fermentadores de lactose12 não são sensíveis à claritromicina.
A claritromicina tem se mostrado ativa contra a maioria das cepas11 dos seguintes micro-organismos, tanto in vitro quanto em infecções1 clínicas:
Micro-organismos Gram-positivos aeróbios: Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes, Listeria monocytogenes.
Micro-organismos Gram-negativos aeróbios: Haemophilus influenzae, Haemophilus parainfluenzae, Moraxella catarrhalis, Neisseria gonorrhoeae, Legionella pneumophila.
Outros micro-organismos: Mycoplasma pneumoniae, Chlamydia pneumoniae (TWAR).
Micobactérias: Mycobacterium leprae, Mycobacterium kansasii, Mycobacterium chelonae, Mycobacterium fortuitum, Mycobacterium avium complex (MAC) consistindo de: Mycobacterium avium e Mycobacterium intracellulare.
A produção de betalactamase não deve apresentar efeitos sobre a atividade da claritromicina.
NOTA: a maioria das cepas11 de estafilococos resistentes à meticilina e à oxacilina são resistentes a claritromicina.
Helicobacter: Helicobacter pylori: em culturas realizadas antes do tratamento, o H. pylori foi isolado e as CIMs da claritromicina foram determinadas em 104 pacientes. Destes, quatro pacientes apresentavam cepas11 resistentes, dois apresentavam cepas11 com sensibilidade intermediária e 98 apresentavam cepas11 sensíveis.
Os seguintes dados in vitro estão disponíveis, mas seu significado clínico é desconhecido. A claritromicina apresenta atividade in vitro contra a maioria das cepas11 dos seguintes micro-organismos; entretanto, a segurança e eficácia da claritromicina no tratamento de infecções1 clínicas devido a esses micro-organismos ainda não foram estabelecidas em estudos clínicos adequados e bem controlados.
Micro-organismos Gram-positivos aeróbios: Streptococcus agalactiae, Streptococci (Grupo C, F e G), Streptococcus viridans.
Micro-organismos Gram-negativos aeróbios: Bordetella pertussis, Pasteurella multocida.
Micro-organismos Gram-positivos anaeróbios: Propionibacterium acnes, Clostridium perfringens, Peptococcus niger.
Micro-organismos Gram-negativos anaeróbios: Bacteroides melaninogenicus.
Espiroquetas: Borrelia burgdorferi, Treponema pallidum.
Campilobacter: Campylobacter jejuni.
O principal metabólito13 da claritromicina em humanos e outros primatas é o metabólito13 microbiologicamente ativo 14-OHclaritromicina. Este metabólito13 é tão ativo quanto, ou 1 a 2 vezes menos ativo do que a substância-mãe para a maioria dos microorganismos, exceto contra o H. influenzae contra o qual é duas vezes mais ativo. A substância-mãe e o metabólito13 14-OH exercem tanto atividade aditiva quanto efeito sinérgico sobre o H. influenzae in vitro e in vivo, dependendo da cepa14 bacteriana.
A claritromicina se mostrou duas a dez vezes mais ativa do que a eritromicina em vários modelos experimentais em animais. Foi demonstrado, por exemplo, que ela é mais ativa do que eritromicina em infecções1 sistêmicas, em abscessos15 cutâneos e infecções1 do trato respiratório em camundongos, causadas por S. pneumoniae, S. aureus, S. pyogenes e H. influenzae. Em cobaias com infecção10 por Legionella, este efeito foi mais pronunciado; uma dose intraperitoneal de 1,6 mg/kg/dia de claritromicina foi mais efetiva do que 50 mg/kg/dia de eritromicina.
Testes de sensibilidade
Os métodos quantitativos que requerem medida dos diâmetros das zonas fornecem estimativas mais precisas da sensibilidade antibiótica. Um procedimento recomendado utiliza discos impregnados com 15 mcg de claritromicina para testar a sensibilidade (teste de difusão de Kirby-Bauer); as interpretações correlacionam o diâmetro das zonas do disco de teste com os valores das CIMs para a claritromicina. As CIMs são determinadas pelo método de diluição em caldo ou ágar. Com este procedimento, um relatório do laboratório de “sensível” indica que o organismo infectante provavelmente responderá ao tratamento. Um relatório de “resistente” indica que o organismo infectante provavelmente não responderá ao tratamento. Um relatório de “sensibilidade intermediária” sugere que o efeito terapêutico da substância pode ser duvidoso ou que o organismo poderia ser sensível se fossem utilizadas doses maiores (este último também é referido como “moderadamente sensível”).
Farmacocinética
Absorção
Estudos iniciais de farmacocinética foram obtidos com a claritromicina na forma farmacêutica de comprimidos. Esses dados indicaram que a absorção é rápida pelo trato gastrointestinal e a biodisponibilidade absoluta de um comprimido de 250 mg de claritromicina é de aproximadamente 50%. Tanto o início da absorção quanto a formação do metabólito13 14-OH-claritromicina foram levemente retardados na presença de alimento, mas a biodisponibilidade não foi afetada na administração do medicamento no estado de desjejum.
Distribuição, Biotransformação e Eliminação
In vitro: estudos in vitro mostraram que a média de ligação protéica da claritromicina no plasma16 humano foi de 70% a concentrações clinicamente relevantes de 0,45 a 4,5 mcg/mL.
Indivíduos normais
A biodisponibilidade e farmacocinética de KLARICID grânulos para suspensão pediátrica foram investigadas em adultos e pacientes pediátricos. Um estudo de dose única em adultos mostrou que a biodisponibilidade da formulação pediátrica é equivalente ou levemente maior que a biodisponibilidade do comprimido (dosagem de 250 mg). Assim como no comprimido, a administração da suspensão pediátrica com alimentos leva a um discreto retardo no início da absorção, mas não afeta a biodisponibilidade total da claritromicina. A Cmáx, ASC (área sob a curva) e o T1/2 da claritromicina suspensão foram de 0,95 mcg/mL, 6,5 mcg hr/mL e 3,7 horas respectivamente, enquanto que, para a forma farmacêutica de comprimidos 250 mg foram 1,10 mcg/mL, 6,3 mcg hr/mL e 3,3 horas, respectivamente.
Em um estudo de dose múltipla em adultos, no qual foram administrados 250 mg de KLARICID grânulos para suspensão pediátrica a cada 12 horas, o “steady-state” foi alcançado após a quinta dose. Os parâmetros farmacocinéticos após a quinta dose de KLARICID grânulos para suspensão pediátrica foram: Cmax 1,98 mcg/mL, ASC 11,5 mcg hr/mL, Tmax 2,8 horas e T1/2 3,2 horas para a claritromicina e 0,67; 5,33; 2,9 e 4,9 respectivamente, para o metabólito13 14-OH-claritromicina.
Em indivíduos saudáveis em jejum, o pico de concentração sérica foi atingido 2 horas após a ingestão da dose oral. Com a dose duas vezes ao dia, sendo administrado um comprimido de 250 mg a cada 12 horas, o pico de concentração sérica de claritromicina no “steady-state” foi alcançado em 2 a 3 dias e foi de, aproximadamente, 1 mcg/mL. O pico de concentração sérica correspondente à dose de 500 mg administrada a cada 12 horas, foi de 2 a 3 mcg/mL.
A meia-vida de eliminação da claritromicina foi em torno de 3 a 4 horas para o comprimido de 250 mg administrado a cada 12 horas e aumentou para 5 a 7 horas quando foram administrados 500 mg a cada 12 horas. O metabólito13 principal, 14-OH-claritromicina, alcança um pico de concentração no “steady-state” de aproximadamente 0,6 mcg/mL e a meia-vida de eliminação é de 5 a 6 horas depois da administração de 250 mg a cada 12 horas. Com a dose de 500 mg a cada 12 horas, o pico de concentração no “steady-state” do 14-OH-claritromicina é discretamente mais alto (até 1mcg/mL), e a meia-vida de eliminação é em torno de 7 horas. Com esta dose, o “steady-state” deste metabólito13 é alcançado em 2 ou 3 dias.
Aproximadamente 20% da dose oral de 250 mg de claritromicina administrada a cada 12 horas é excretado na urina17 de forma inalterada. Para a dose de 500 mg administrada a cada 12 horas, a excreção na urina17 na forma inalterada é de aproximadamente 30%.
No entanto, o clearance renal18 da claritromicina é relativamente independente da dose e se aproxima do índice regular de filtração glomerular. O principal metabólito13 encontrado na urina17 é a 14-OH-claritromicina, o qual responde por 10 a 15% adicionais, tanto para doses de 250 mg ou 500 mg, administradas a cada 12 horas.
Pacientes
A claritromicina e seu metabólito13 14-OH são facilmente distribuídos nos tecidos e fluidos corporais.
A concentração nos tecidos é normalmente maior que a concentração sérica. Exemplos de concentrações séricas dos tecidos e fluídos corporais são apresentados abaixo:

Em pacientes pediátricos, a claritromicina demonstrou boa biodisponibilidade com um perfil farmacocinético coerente com resultados prévios de adultos usando a mesma formulação de suspensão. Os resultados indicaram uma absorção rápida e extensa em pacientes pediátricos e, com exceção de um leve retardo no início da absorção, a alimentação parece não afetar significantemente a biodisponibilidade e perfil farmacocinético da claritromicina. Os parâmetros farmacocinéticos obtidos após a nona dose no quinto dia de tratamento foram os seguintes para a claritromicina: Cmax 4,60 mcg/mL, ASC 15,7 mcg/hr/mL e Tmax 2,8 horas. Os valores correspondentes para o metabólito13 14-OH-claritromicina foram: 1,64 mcg/mL, 6,69 mcg/hr/mL e 2,7 horas, respectivamente. A meia-vida de eliminação foi de aproximadamente 2,2 horas e 4,3 horas para a substância-mãe e seu metabólito13, respectivamente.
Em outro estudo, informações foram obtidas a partir da administração de claritromicina no ouvido médio4 em pacientes com otite19.
Aproximadamente 2,5 horas depois de receber a quinta dose (a dose era de 7,5 mg/kg duas vezes ao dia), a concentração de claritromicina era de 2,53 mcg/g de fluido no ouvido médio4 e a concentração do metabólito13 14-OH-claritromicina era de 1,27 mcg/g.
A concentração da substância-mãe e seu metabólito13 foram quase o dobro da concentração sérica correspondente.
Insuficiência hepática20
A concentração de claritromicina no “steady-state” em indivíduos com insuficiência hepática20, não difere da concentração em indivíduos sadios. No entanto, a concentração do metabólito13 14-OH-claritromicina foi menor em indivíduos com insuficiência hepática20. O decréscimo na formação desse metabólito13 compensou o aumento no clearance renal18 da claritromicina quando comparados a indivíduos sadios.
Insuficiência renal21
A farmacocinética da claritromicina foi alterada em indivíduos com insuficiência renal21 que receberam múltiplas doses de 500 mg. Os níveis plasmáticos, a meia-vida, Cmáx, Cmín e a ASC da claritromicina e de seu metabólito13 foram maiores nos pacientes com insuficiência renal21. Essas alterações são correlacionadas ao grau de insuficiência renal21; quanto mais grave a insuficiência22, mais significativa é a diferença.
Pacientes idosos
Em um estudo comparativo entre indivíduos jovens sadios e idosos sadios recebendo 500 mg de claritromicina em doses orais múltiplas, os níveis plasmáticos foram maiores e a eliminação foi mais lenta no grupo dos idosos. No entanto, não houve diferença entre os dois grupos quando o clearance renal18 da claritromicina foi relacionado com o clearance da creatinina23. Concluiu-se que qualquer efeito com relação à claritromicina não está ligado à idade do paciente, e sim à função renal18.
Pacientes com infecções1 por micobactérias
As concentrações de equilíbrio da claritromicina e seu metabólito13 14-OH-claritromicina, observadas após administração das doses usuais em pacientes infectados pelo HIV24 (comprimidos para os adultos e suspensão pediátrica para as crianças), foram semelhantes àquelas observadas em indivíduos normais. Entretanto, com as doses elevadas que podem ser requeridas para o tratamento de infecções1 por micobactérias, as concentrações da claritromicina podem ser muito maiores do que aquelas observadas com as doses usuais.
Em crianças infectadas pelo HIV24 utilizando entre 15 a 30 mg/kg/dia de claritromicina divididas em duas administrações, a Cmáx, geralmente foi entre 8 e 20 mcg/mL. Entretanto, foram observados valores de Cmáx, superiores a 23 mcg/mL em crianças infectadas pelo HIV24 que utilizaram 30 mg/Kg/dia divididas em duas administrações de claritromicina suspensão pediátrica. A meia-vida de eliminação mostra-se mais longa nas altas doses comparando-se com as doses usuais administradas em indivíduos normais. Os dados de farmacocinética de maior concentração plasmática e meia-vida de eliminação mais longa observados nestas circunstâncias são consistentes com a conhecida não linearidade da farmacocinética da claritromicina.
Estudos clínicos
Experiência clínica em pacientes com infecções1 não causadas por micobactérias: em estudos clínicos, a claritromicina, na dose de 7,5 mg/kg duas vezes ao dia, se mostrou segura e eficaz no tratamento de pacientes pediátricos com infecções1 que requeriam tratamento antibiótico oral. A claritromicina foi avaliada em mais de 1200 crianças, de idade entre seis meses e 12 anos, com otite média3, faringite25, infecções1 cutâneas26 e infecções1 do trato respiratório inferior. Nesses estudos, a claritromicina, na dose de 7,5 mg/kg das vezes ao dia, apresentou eficácia clínica e bacteriológica comparável àquela dos agentes de referência, incluindo a penicilina-V, amoxicilina, amoxicilina-clavulanato, etilssuccinato de eritromicina, cefaclor e cefadroxila.
Experiência clínica em pacientes com infecções1 causadas por micobactérias: um estudo preliminar em pacientes pediátricos (alguns dos quais HIV24 positivos) com infecções1 causadas por micobactérias, demonstrou que a claritromicina foi segura e eficaz quando administrada isoladamente ou em combinação com a zidovudina ou dideoxinosina. A claritromicina suspensão pediátrica foi administrada nas doses de 7,5 mg/kg, 15 mg/kg ou 30 mg/kg, divididas em duas administrações. Foram observados alguns efeitos sobre os parâmetros de farmacocinética quando a claritromicina foi administrada concomitantemente com compostos antirretrovirais, mas as alterações foram mínimas e provavelmente sem significado clínico. As doses de claritromicina de até 30 mg/kg/dia foram bem toleradas. A claritromicina foi eficaz no tratamento de infecções1 disseminadas causadas por bactérias do complexo M. avium em pacientes pediátricos com AIDS, sendo que em alguns pacientes foi demonstrada eficácia após mais de um ano de tratamento.
Dados de segurança pré-clínica
Estudos de toxicidade27 oral aguda e subcrônica:
Valores de DL50 oral aguda para a claritromicina suspensão administrada em 3 dias em camundongos velhos foi de 1290 mg/Kg para machos e 1230 mg/Kg em fêmeas. O valores DL50 de 3 dias em ratos velhos foram de 1330 mg/Kg para machos e 1270 mg/Kg em fêmeas. Por comparação, a DL50 de claritromicina administrada oralmente é cerca de 2700 mg/kg em camundongos adultos e cerca de 3000 mg/Kg em ratos adultos. Estes resultados são coerentes com outros grupos de antibióticos penicilínicos, cefalosporínicos e macrolídeos em que, geralmente, a DL50 é menor em animais mais jovens do que em adultos.
Em ambos os camundongos e ratos, o peso corpóreo foi reduzido ou seu aumento suprimido e a amamentação28 e movimentos espontâneos foram deprimidos para os primeiros dias seguintes da administração do fármaco29. A necropsia30 dos animais mortos revelaram pulmões31 escuro-avermelhados em camundongos e em cerca de 25% dos ratos; ratos tratados com 2197 mg/Kg ou mais de claritromicina suspensão também notaram uma substância negro-avermelhada no intestino, provavelmente devido à sangramento. A morte desses animais foi devido à debilitação resultante do comportamento de amamentação28 deprimida ou do sangramento intestinal.
Foi administrada claritromicina suspensão, por duas semanas, em ratos pré-desmame (5 dias de vida), nas doses de 0, 15, 55 e 200 mg/Kg/dia. Animais do grupo de 200 mg/Kg/dia diminuíram o ganho de peso corporal, diminuíram os valores médios de hemoglobina32 e hematócrito33, e aumentaram a média relativa de peso dos rins34, em comparação à animais do grupo controle.
Foram também observados em animais deste grupo de tratamento, mínima a leve degeneração35 vacuolar multifocal do epitélio36 do ducto biliar intra-hepático e uma incidência7 aumentada de lesões37 nefríticas, relacionadas ao tratamento. Para este estudo, a dose de efeito “não-tóxico” foi de 55 mg/Kg/dia.
Foi conduzido um estudo de toxicidade27 oral, no qual foi administrada claritromicina suspensão em ratos imaturos, com doses diárias de 0,15, 50, e 150 base/Kg/dia, durante 6 semanas. Não ocorreram mortes e os sinais38 clínicos observados foram salivação excessiva para alguns dos animais após 1 ou 2 horas da administração da dosagem mais alta, durante as últimas três semanas de tratamento.
Quando comparados ao grupo controle, os ratos do grupo com dosagem de 150 mg/Kg tiveram peso corpóreo médio mais baixo durante as primeiras três semanas e observou-se diminuição do valor médio de albumina39 sérica e um aumento do peso relativo médio do fígado40.
Foram encontradas alterações histopatológicas brutas ou microscópicas não relacionadas ao tratamento. A dose de 150 mg/Kg produziu toxicidade27 leve nos ratos e a dose de 50 mg/Kg/dia foi considerada “sem efeito de dose”.
Em cães juvenis da raça beagle, com 3 semanas de idade, tratados durante 4 semanas com doses orais diárias de 0, 30, 100, ou 300 mg/Kg de claritromicina, seguido de um período de recuperação de 4 semanas, não ocorreu nenhum óbito41 e também não foi observada nenhuma alteração na condição geral dos animais.
A necropsia30 não revelou anormalidades. No grupo de dose de 300 mg/Kg, sob exame histológico42, foram observadas, deposição de gordura43 de hepatócitos centrolobulares e infiltração celular de área portal por microscopia de luz e por microscopia eletrônica foram notados aumento de gotículas de gordura43 hepatocelulares. A dose tóxica em cães beagles juvenis foi considerada maior do que 300 mg/Kg e de 100 mg/Kg considerou-se “sem efeito de dose”.
Fertilidade, Reprodução44 e Teratogenicidade
Estudos de fertilidade e reprodução44 têm mostrado que doses de 150 a 160 mg/kg/dia em ratos machos e fêmeas não causaram eventos adversos no ciclo fértil, fertilidade, parto e no número e viabilidade da prole. Estudos de teratogenicidade realizados em ratos, coelhos e macacos não demonstraram qualquer efeito teratogênico45 com o uso de claritromicina. Somente em um estudo adicional em ratos Sprague-Dawley, com doses e condições essencialmente similares, ocorreu uma incidência7 muito baixa e estatisticamente insignificante (aproximadamente 6%) de anormalidades cardiovasculares. Essas anomalias parecem ser devido à expressão espontânea de mudanças genéticas dentro da colônia. Dois estudos realizados em camundongos revelaram uma incidência7 variável da fenda palatina (3 a 30%) em doses 70 vezes acima da dose habitual diária utilizada em humanos (500 mg 2x/dia), mas não mais que 35 vezes a dose máxima diária sugerindo toxicidade27 materna e fetal, mas não teratogenicidade. Doses de claritromicina, aproximadamente dez vezes maiores que a dose habitual máxima utilizada em humanos (500 mg 2x/dia), administradas em macacos a partir do 20° dia de gravidez46 tem demonstrado perda embrionária. Esse efeito tem sido atribuído à toxicidade27 materna da droga em altas doses. Um estudo adicional em macacas grávidas utilizando doses aproximadamente 2,5 a 5,0 vezes maiores que a dose habitual (500 mg 2x/dia) não demonstraram nenhum risco ao embrião.
O teste letal dominante em camundongos utilizando 1000 mg/kg/dia (aproximadamente 70 vezes da dose máxima diária em humanos de 500 2x/dia) foi claramente negativo para qualquer atividade mutagênica e em um estudo com ratos tratados com 500 mg/kg/dia (aproximadamente 35 vezes da dose máxima diária em humanos de 500 2x/dia) por 80 dias não evidenciaram riscos funcionais na fertilidade masculina em exposição em longo prazo com doses muito altas de claritromicina.
Mutagenicidade
Foram realizados estudos para avaliar o potencial mutagênico da claritromicina, através de sistemas de testes com microssomas hepáticos de ratos ativados e não ativados (Teste de Ames). Os resultados desses estudos não evidenciaram potencial mutagênico para concentrações iguais ou menores a 25 mcg de claritromicina por placas47 de Petri. Numa concentração de 50 mcg, a droga foi tóxica para todas as cepas11 testadas.
- 4. CONTRAINDICAÇÕES
KLARICID é contraindicado para o uso por pacientes com conhecida hipersensibilidade aos antibióticos macrolídeos e a qualquer componente da fórmula.
A administração concomitante de claritromicina com astemizol, cisaprida, pimozida e terfenadina está contraindicada, pois pode resultar em prolongamento QT e arritmias48 cardíacas incluindo taquicardia49 ventricular, fibrilação ventricular e torsades de pointes.
A administração concomitante de claritromicina com alcaloides de ergot (ex: ergotamina ou diidroergotamina) é contraindicada pois, pode resultar em toxicidade27 ao ergot.
A coadministração de claritromicina e midazolam oral é contraindicada (ver Interações Medicamentosas).
A claritromicina não deve ser administrada a pacientes com histórico de prolongamento do intervalo QT (congênito50 ou adquirido) ou arritmia51 ventricular cardíaca, incluindo torsades de pointes (ver Advertências e Precauções e Interações medicamentosas).
Claritromicina não deve ser indicada para pacientes52 com hipocalemia53 (risco de prolongamento do intervalo QT).
Claritromicina não deve ser usada em pacientes que sofrem de insuficiência hepática20 grave em combinação com insuficiência renal21.
A claritromicina não deve ser utilizada concomitantemente com inibidores da HMG-CoA redutase (estatinas) que são extensivamente metabolizados pela CYP3A4 (lovastatina ou sinvastatina), devido a um aumento no risco de miopatia54, incluindo rabdomiólise55 (ver Advertências e Precauções).
Claritromicina (e outros inibidores fortes de CYP3A4) não deve ser utilizada em combinação com colchicina (ver Advertências e Precauções e Interações Medicamentosas).
A administração concomitante com ticagrelor ou ranolazina é contraindicada.
Este medicamento é contraindicado para menores de 6 meses de idade.
Gravidez46: Categoria de risco: C


