Botox (Bula do profissional de saúde)
ALLERGAN PRODUTOS FARMACÊUTICOS LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
BOTOX®
toxina1 botulínica A
Pó congelado a vácuo estéril
APRESENTAÇÕES
Pó congelado a vácuo estéril.
Frasco-ampola contendo 50, 100 ou 200 Unidades de toxina1 botulínica A (*).
VIA INTRAMUSCULAR / INTRADÉRMICA conforme indicação de tratamento
USO ADULTO E PEDIÁTRICO ACIMA DE 2 ANOS
COMPOSIÇÃO
Cada frasco-ampola contém:
BOTOX® 50U - 50 Unidades (**) de toxina1 botulínica A (*), albumina2 humana e cloreto de sódio.
BOTOX® 100U - 100 Unidades (**) de toxina1 botulínica A (*), albumina2 humana e cloreto de sódio.
BOTOX® 200U - 200 Unidades (**) de toxina1 botulínica A(*), albumina2 humana e cloreto de sódio.
(*) BOTOX® é uma forma congelada a vácuo e estéril da toxina1 botulínica A, produzida a partir da cultura da cepa3 Hall de clostridium botulinum tipo A, desenvolvida em meio contendo hidrolisado de caseína, glicose4 e extrato de levedura.
(**) Cada unidade (U) corresponde à dose intraperitonial letal média (DL50) de BOTOX® calculada em camundongos. Os métodos utilizados para realizar a determinação da atividade biológica são específicos do produto da Allergan - BOTOX® - e podem ser realizados tanto por meio da determinação da DL50 em camundongos como por meio de um ensaio de potência alternativo totalmente in vitro, baseado em células5. Devido aos detalhes desta determinação, tais como veículo, esquema de diluição e protocolos laboratoriais, as unidades da atividade biológica de BOTOX® não podem ser comparadas ou convertidas em unidades de quaisquer outras toxinas6 botulínicas avaliadas através de quaisquer outros métodos específicos. A atividade específica de BOTOX® é de aproximadamente 20 unidades/nanograma do complexo proteico de neurotoxina.
Entendendo, portanto, que os produtos biológicos não são iguais, a agência regulatória norte-americana, Food and Drug Administration (FDA) atribuiu nomenclaturas diferenciadas às toxina1 botulínicas A comercializadas nos Estados Unidos. A toxina1 botulínica A, fabricada pela empresa Allergan - BOTOX®, recebeu a nomenclatura “OnabotulinumtoxinA” (Toxina1 Onabotulínica A, em português – Farmacopéia Brasileira). Desta forma, a nomenclatura OnabotulinumtoxinA / Toxina1 Onabotulínica A pode ser encontrada em informações de literatura e material impresso referente ao produto BOTOX®.
A composição do produto segue inalterada, as diferentes nomenclaturas reforçam a existência de diferenças entre as preparações de toxina1 botulínica A, principalmente em relação às potências individuais, e a não intercambialidade melhorando a segurança na prescrição, no uso e na administração de toxinas6 botulínicas.
Como estas unidades são exclusivas para BOTOX® e não são intercambiáveis com outras preparações/ marcas comerciais de toxina1 botulínica, recomenda-se a anotação da marca do produto, com identificação de lote na ficha dos pacientes.
INFORMAÇÕES TÉCNICAS AOS PROFISSINAIS DE SAÚDE7
INDICAÇÕES
BOTOX® é indicado para:
- Tratamento de estrabismo8 e blefarospasmo associado com distonia9, incluindo blefarospasmo essencial benigno ou distúrbios do VII par craniano10 em pacientes com idade acima de 12 anos
- Tratamento de distonia9 cervical
- Tratamento de espasmo11 hemifacial
- Tratamento de espasticidade12 muscular
- Tratamento de linhas faciais hipercinéticas
- Tratamento de hiperidrose13 focal, palmar14 e axilar
- Tratamento de incontinência urinária15 causada por hiperatividade neurogênica do músculo detrusor16 da bexiga17, não tratada adequadamente por anticolinérgicos.
- Tratamento da bexiga17 hiperativa com sintomas18 de incontinência19, urgência20 e aumento da frequência urinária em pacientes adultos que obtiveram resposta inadequada ou intolerantes à anticolinérgicos
- Profilaxia em adultos de migrânea21 crônica* - enxaquecas22 crônicas e refratárias23 com comprometimento importante da qualidade de vida e das atividades diárias (laborativas, sociais, familiares e de lazer)
*o termo “enxaqueca” e “migrânea” são sinônimos.
RESULTADOS DE EFICÁCIA
Todas as indicações de BOTOX® foram avaliadas em estudos clínicos controlados, randomizados, duplo-cegos comparativos com placebo24 ou abertos. A documentação é extensa e fornece resultados de eficácia diferenciados conforme a indicação, de modo que são mencionados apenas alguns desses resultados:
Estrabismo8: Em estudo, 677 pacientes com estrabismo8 foram tratados com uma ou mais injeções e 55% desses pacientes melhoram o alinhamento ocular em 10 dioptrias ou menos quando avaliados 6 meses ou mais após as injeções. (Scott AB. Botulinum Toxin Treatment of Strabismus. Focal Points. 1989; 7: 1-11)
Blefaroespasmo25: Foi conduzido um estudo clínico randomizado26, multicêntrico, duplo-cego, paralelo, comparando a segurança e eficácia de 2 formulações de BOTOX® em 98 pacientes com blefaroespasmo25 essencial benigno por um período de 12 semanas. A dose (máxima utilizada foi de 100 unidades) e locais de injeção27 foram determinados pelo investigador com base na resposta do paciente ao tratamento anterior com BOTOX®. A dose média recebida pelos pacientes foi de 33 unidades por olho28, injetado em 3 a 15 pontos. Comparando com a formulação anterior, a taxa de sucesso de tratamento com a atual formulação do BOTOX® foi cerca de 90% na quarta semana. (Allergan. 191622-003 A randomized, multicenter, double-blind, parallel clinical trial to compare the safety and efficacy of BOTOX® (botulinum toxin type A) purified neurotoxin complex manufactured from neurotoxin complex batch BCB 2024 to that manufactured from neurotoxin complex batch 79-11 in blepharospasm patients, 1997)
Espasmohemifacial: Em um estudo aberto, 56 pacientes com espasmo11 hemifacial foram injetados com uma dose inicial de 10 a 50 unidades e observados por 22 semanas. Todos os pacientes mostraram melhoria, e 62,5% (35/56) mostraram melhora acentuada. Quando os músculos faciais29 superiores foram avaliados individualmente a melhora foi observada em todos os pacientes. Quando os músculos faciais29 inferiores foram avaliados individualmente somente 2 pacientes foram considerados não responsivos. (Allergan Inc. Blepharospasm/hemifacial spasm MAA; Part IV B, Vol 3: 627-893 (study 003) and Part IV B, Vol 3: 894- (study 504). 2000. Ref Type: Data File)
Distúrbios do VII par craniano10: Em estudo retrospectivo30 envolvendo 10 anos de seguimento de pacientes foram comparadas as variáveis clínicas e resposta ao tratamento entre pacientes com distonia9 idiopática31 de fechamento de mandíbula32 (DIFM) (n=11) e distonia9 idiopática31 de abertura de mandíbula32 (DIAM) (n=12). Nos resultados, a coexistência de distonia9 em outras regiões e do desenvolvimento de truques sensoriais foram significativamente mais prevalentes na DIAM (P=0.049). As melhores resposta às injeções de BOTOX® foram na DIFM em pacientes do sexo masculino, e com discinesia orobucolingual associada (alterações da expressão facial, morder lábio33, discinesia de língua34, contrações do músculo platisma e bruxismo). A dose média de BOTOX® foi de 150 unidades. (Singer C, Papapetropoulos S. A comparison of jaw-closing and jaw-opening idiopathic oromandibular dystonia. Parkinsonism Relat Disord 2006;12:115-8)
Distonia9 cervical: Um estudo multicêntrico, randomizado26, duplo cego, placebo24 controlado foi conduzido com pacientes adultos portadores de DC. O estudo foi dividido em 2 períodos de tratamento: um período “aberto” durante o qual todos os pacientes receberam tratamento de BOTOX®, com dosagem e locais de injeção27 determinados em base individual pelo investigador; e um período duplo cego onde os pacientes considerados responsivos no período “aberto” receberam BOTOX® ou placebo24. A dose total de BOTOX® foi de até 360U. Os pacientes foram seguidos então em intervalos de 2 semanas no pós-tratamento até 10 semanas. BOTOX® foi tanto clinicamente e estatisticamente significativamente superior ao placebo24 no que diz respeito às duas variáveis de eficácia primária em 6 semanas. BOTOX® também foi estatisticamente significativamente melhor que o placebo24 na redução da intensidade e frequência de dor. Melhoras significativas na avaliação de incapacidade funcional realizadas pelo médico e paciente na sexta semana foram também observadas. (Allergan. BTX-140- 8051 A randomized, multicenter, double-blind, placebo24-controlled study of intramuscular BOTOX® (botulinum toxin type A) purified neurotoxin complex for the treatment of cervical dystonia, 1999; Brashear et al. Randomized Double-Blind, Placebo24-Controlled Study of Intramuscular BOTOX® for the treatment of Cervical Dystonia. 5th International Congress of Parkinson's Disease and Movement Disorders, 1998)
Um estudo adicional duplo cego, randomizado26 cruzado estudou a segurança e eficácia de 2 formulações de BOTOX® incluindo pacientes que tinham sido previamente tratados com resultados satisfatórios, o tratamento consistia de 2 injeções separadas por um período de 8 a 16 semanas. Os pacientes foram acompanhados por 8 a 16 semanas após cada tratamento com o registro dos resultados de eficácia primária na semana 6 depois de cada tratamento. Os resultados mostraram melhora clínica máxima após uma injeção27 de BOTOX® observada na semana 6. A redução média na pontuação de TWSTRS (Toronto Western Spasmodic Torticollis Rating Scale) total representou uma melhoria de 35% para a dor o que representou uma diminuição de 50% da linha base. A avaliação global por médicos e pacientes também demonstrou efeito positivo em mais de 85% dos pacientes com a atual formulação do BOTOX®, e, houve o relato de sucesso no tratamento na sexta semana em 80% dos pacientes. (Allergan. 191622-503 A Randomized, Double-Masked, Cross-Over Comparison of the Efficacy and Safety of Intramuscular BOTOX® (botulinum toxin type A) Purified Neurotoxin Complex Manufactured from GMP Bulk Toxin (Formulation No 9060X) with that Manufactured from Lot 79-11 (Formulation No 8051X), 1999)
Espasticidade12: Em um estudo paralelo, placebo24 controlado, duplo-cego de 3 meses realizado em crianças com paralisia35 cerebral, com idades entre 2 a 16 anos portadoras de pés equinos, 72 pacientes foram tratados com 4 U/kg peso de BOTOX® para as cabeças mediais e laterais do músculo gastrocnêmio36 (2 U/kg/músculo para pacientes37 hemiplégicos e 1U/kg/músculo para pacientes37 diplégicos) e re-tratados novamente na semana 4. A dose cumulativa de BOTOX® em mais de 4 semanas foi de 2- 4 U/kg/muscular e no geral 8 U/kg de peso até ao máximo de 200 unidades por tratamento. BOTOX® foi significativamente mais eficaz que o placebo24, avaliando-se a melhoria de 2 ou mais pontos medidos pela Physician’s Rating Scale (PRS) no quesito padrão de marcha dinâmica. No estudo a longo prazo, de 39 meses, na parte de acompanhamento aberto destes pacientes, os músculos38 gastrocnêmio medial e lateral receberam dose de 2 U/kg/músculo com uma dose total máxima de 200U de BOTOX®. A porcentagem de 41% a 67% dos pacientes mostraram uma melhora, baseada no PRS do padrão de marcha dinâmico no período de 3 anos. (Allergan. OCUL-119-8051 A multicenter, open-label clinical trial of BOTOX® (botulinum toxin type A) injectable for pediatric ambulatory cerebral palsy. 1996) Estudos para a redução da espasticidade12 dos músculos38 adutores de coxa39 mostraram que BOTOX® é eficaz na redução da dor e da espasticidade12, melhorando a função de quadril. Um estudo duplo-cego40 placebo24-controlado (n = 16), em crianças com idades entre 2 a 10 anos, mostrou que 4 unidades de BOTOX®/kg de peso para cada grupo de músculo adutor (dose total 8 unidades/kg de peso) administrada 5-10 dias antes de cirurgia isolada e programada de adutores reduz significativamente as pontuações das escalas de dor. (Barwood S, Baillieu C, Boyd R et al. Analgesic effects of botulinum toxin A: a randomized, placebo24-controlled clinical trial. Developmental Medicine & Child Neurology 2000 February;42(2):116-21)
A Allergan concluiu 13 estudos em espasticidade12 pós Acidente Vascular41 Encefálico (AVE) em membros superiores, incluindo 5 estudos abertos e 8 estudos duplo-cego, controlado por placebo24 totalizando 900 pacientes incluídos. 840 pacientes da população do grupo BOTOX® foram tratados com doses de 75U a 400U e 211 com placebo24. Todos os 13 estudos avaliaram o tônus dos flexores do punho, 12 estudos avaliados tônus dos flexores de dedos e 5 estudos foram “desenhados” especificamente para demonstrar estatisticamente e clinicamente a melhoria significativa do tônus flexor tendo como medida a Escala de Ashworth Modoficada - MAS e a Escala de Avaliação Global do Médico- PRS. As análises integradas através destes ensaios controlados e os resultados específicos dos estudos indicam que BOTOX® é um tratamento seguro, bem tolerado e eficaz de espasticidade12 muscular focal em membros superiores.
Linhasfaciaishipercinéticas: Em 2 estudos multicêntricos, duplos-cegos comparativos com placebo24 em 537 pacientes com linhas glabelares, os índices de resposta atingiram 80% a 89% para todas as variáveis de eficácia. (Allergan. 191622-010 A multicenter, double-blind, randomized, placebo24-controlled, parallel study of the safety and efficacy of BOTOX® (botulinum toxin type A) Purified Neurotoxin Complex in subjects with glabellar lines, 1999; Allergan. 191622-023 A multicenter, double-blind, randomized, placebo24-controlled, parallel study of the safety and efficacy of BOTOX® (botulinum toxin type A) Purified Neurotoxin Complex in subjects with glabellar lines. 2000). Injeções de BOTOX® reduziram a severidade nas linhas frontais por até 24 semanas. Os índice de resposta ao tratamento foram de 75% a 90% dos pacientes tratados. Injeções de BOTOX® na área lateral orbital reduziram a severidade nas linhas por até 16 semanas. Os índice de resposta ao tratamento foram de 60% a 95% dos pacientes tratados. (Carruthers A. Botulinum Toxin and Laser Resurfacing for Lines around the eyes. In: Blitzer A. BWBJBCA, editor. Management of Facial lines and Wrinkles. Philadelphia: Lippincott, Williams and Wilkins; 2000. p. 315-32)
Hiperidrose13: Foi observada resposta favorável em 93,8% com a toxina1 botulínica tipo A em comparação com placebo24 (35,9%) em estudo envolvendo 328 pacientes. (Naumann M. Scientific and Therapeutic Aspects of Botulinum Toxin, 2002). Em um estudo duplo-cego40, placebo24 controlado com 322 pacientes com hiperidrose13 primária resistente, randomizados em 1:1:1 receberam tratamentos com 50U BOTOX® (N=104), 75U de BOTOX® (N=110) ou placebo24 (N=108). O índice de resposta ao tratamento foi maior nos pacientes que receberam 50U (54.8%) e 75U (49.1%) de BOTOX® do que no grupo placebo24 (5.6%) (p < 0.001). (Allergan. 191622-016 A multicenter, double-blind, randomized, placebo24-controlled, parallel study of the safety and efficacy of repeated treatment with one of two dosages of BOTOX® (botulinum toxin type A) purified neurotoxin complex for the treatment of primary axillary hyperhidrosis, 2003).
Bexiga17 Hiperativa: Em dois estudos duplo-cegos, placebo24 controlados, multicêntricos de Fase III de 24 semanas, um total de 1105 pacientes com bexiga17 hiperativa com sintomas18 de incontinência19, urgência20 e frequência urinária foram randomizados para receber 100U de BOTOX® (n=557) ou placebo24 (n=548). Nos dois estudos, houve melhora significativa em comparação com placebo24, na variável de eficácia primária de mudança de linha de base relativa à frequência diária de episódios de incontinência19, no ponto de tempo de eficácia primária de 12 semanas, incluindo uma percentagem de pacientes secos foram observadas. Melhorias significativas foram observadas em todos os sintomas18 a partir da semana 2. Melhorias significativas comparada ao placebo24 também foram observadas relativa a frequência diária de micção42, urgência20 e episódios de nocturia. Foram também relatadas melhoras significativas no paciente relacionadas com a saúde7 e com a qualidade de vida, medidas pelo Incontinence Quality of Life questionnaire (I-QOL) (incluindo prevenção e limitação do comportamento, impacto psicológico e constrangimento social) e pelo King’s Health Questionnaire (KHQ) (incluindo impacto da incontinência19, limitações de comportamento, social, emocional, sono/ energia). (Allergan. 191622-095/ 191622-520 - A multicenter, double-blind, randomized, placebo24-controlled, parallel-group study of the safety and efficacy of a single treatment of BOTOX® (botulinum toxin type A) followed by a Treatment with BOTOX® as applicable in patients with idiopathic overactive bladder with Urinary Incontinence 2012).
Bexiga17 hiperativa neurogênica: Dois estudos clínicos duplo-cego, placebo24-controlado, randomizados, multicêntrico de fase 3 foram conduzidos em pacientes com incontinência urinária15 causada por hiperatividade neurogênica do músculo detrusor16 da bexiga17, não tratada adequadamente por anticolinérgicos. Um total de 691 pacientes com lesão43 da medula espinhal44 ou pacientes de esclerose múltipla45, não adequadamente tratados por agente anticolinérgico, foram inscritos. Esses pacientes foram randomizados para receber 200U de BOTOX® (n = 227), 300U de BOTOX® (n = 223), ou placebo24 (n = 241). Em dois estudos fase 3, foram notadas melhoras significativas no grupo tratado com BOTOX® (200U e 300U) em comparação com placebo24, na variável de eficácia primária de mudança de linha de base relativa à frequência semanal de episódios de incontinência19, no ponto de tempo de eficácia primária de 6 semanas, incluindo a percentagem de pacientes secos. Melhoras significativas nos parâmetros de urodinâmica, incluindo o aumento da capacidade máxima cistometrica também foram observadas, assim como diminuições na pressão pico do músculo durante a primeira contração involuntária46 do músculo. Foram também relatadas melhorias significativas no paciente relacionadas com a saúde7 e com a qualidade de vida, medidas pelo Incontinence Quality of Life questionnaire (I-QOL) (incluindo prevenção e limitação do comportamento, impacto psicológico e constrangimento social). A duração média de resposta nos dois estudos, com base na solicitação dos pacientes para re-tratamento, foi de 256-295 dias (36-42 semanas) para o grupo de dose 200 unidades em comparação com 92 dias (13 semanas) com placebo24. Para todos os pontos de eficácia, os pacientes experimentaram resposta consistente com o re-tratamento. Nos estudos piloto, nenhum dos pacientes com inadequação neurogênica do músculo detrusor16 (n= 475) desenvolveu anticorpos47 neutralizantes. (Allergan. 191622-515. A Multicenter, Double-Blind, Randomized, Placebo24-Controlled, Parallel-Group Study of the Safety and Efficacy of a Single Treatment with Two Dose Levels of BOTOX® (Botulinum Toxin Type A) Purified Neurotoxin Complex Followed by Treatment with BOTOX® in Patients with Urinary Incontinence Due to Neurogenic Detrusor Overactivity. 2010; Allergan. 191622-516. A Multicenter, Double-Blind, Randomized, Placebo24-Controlled, Parallel-Group Study of the Safety and Efficacy of a Single Treatment with Two Dose Levels of BOTOX® (Botulinum Toxin Type A) Purified Neurotoxin Complex Followed by a Treatment with BOTOX® in Patients with Urinary Incontinence Due to Neurogenic Detrusor Overactivity. 2010)
Migrânea21 crônica: BOTOX® foi avaliado em dois estudos clínicos de Fase III, multicêntricos, multinacionais, de 56 semanas, que incluíram uma fase duplamente cega de 24 semanas, com dois ciclos de injeção27, comparativa entre BOTOX® e placebo24, seguida por uma fase aberta de 32 semanas, com três ciclos de injeção27. Ao todo foram estudados 1.384 adultos portadores de migrânea21 crônica [688 nos grupos tratados com BOTOX® e 696 nos grupos tratados com placebo24], que nunca haviam recebido ou que não estavam recebendo qualquer profilaxia para cefaleia48 concomitantemente durante o período basal de 28 dias, apresentavam crises de cefaleia48 por ≥ 15 dias, 50% deles portadores de enxaqueca49/enxaqueca49 provável, e ≥ 4 episódios de cefaleia48. Esses pacientes foram randomizados para receberem injeções de placebo24 ou de BOTOX® nas doses de 155 unidades até 195 unidades a cada 12 semanas, com o máximo de 5 ciclos de injeção27. Foi permitido o uso de tratamentos agudos para cefaleia48 (65,5% dos pacientes fez uso agudo50 abusivo desses tratamentos no período basal). Foi demonstrado que o tratamento com BOTOX® proporcionou melhora estatisticamente significativa (p<0,001) e melhora clinicamente relevante em relação à avaliação basal em comparação com o placebo24 para as variáveis principais de eficácia (frequência de dias com cefaleia48, de dias com enxaqueca49 provável, número de dias com enxaqueca49 moderada/grave, frequência de episódios de enxaqueca49). Os resultados do ensaio Headache Impact Test - (HIT-6) e os questionários de qualidade de vida específicos de enxaqueca49 (MSQ – Migraine-Specific Quality of Life) indicaram que BOTOX® teve uma duração de ação sustentada e apresentou melhores pontuações para funcionalidade, vitalidade, distúrbios psicológicos e totais de qualidade de vida. (Allergan. 191622-079: A Multicenter Study Evaluating the Efficacy and Safety of BOTOX® (Botulinum Toxin Type A) Purified Neurotoxin Complex as Headache Prophylaxis in Migraine Patients with 15 or more Headache Days per 4-week Period in a 24-week, Double-blind, Randomized, Placebo24-controlled, Parallel-group Phase followed by a 32-week Open-label Extension Phase; Allergan. 191622-080: A Multicenter Study Evaluating the Efficacy and Safety of BOTOX® (Botulinum Toxin Type A) Purified Neurotoxin Complex as Headache Prophylaxis in Migraine Patients with 15 or more Headache Days per 4-week Period in a 24-week, Double-blind, Randomized, Placebo24- controlled, Parallel-group Phase followed by a 32-week Open-label Extension Phase)
CARACTERÍSTICAS FARMACOLÓGICAS
Farmacologia51 Clínica
BOTOX® é classificado terapeuticamente como agente paralisante neuromuscular. Age bloqueando a condução neuromuscular devido à ligação nos receptores terminais dos nervos simpáticos motores, inibindo a liberação de acetilcolina52. Quando injetado por via intramuscular em doses terapêuticas, provoca o relaxamento muscular parcial por denervação53 química localizada.
Quando um músculo é desnervado quimicamente pode ocorrer atrofia54 e podem se desenvolver receptores de acetilcolina52 extrajuncionais.
Farmacodinâmica
O princípio ativo de BOTOX® é um complexo proteico derivado do clostridium botulinum. A toxina1 botulínica do tipo A, quando injetada no músculo, inibe temporariamente a junção neuromuscular55, através da inibição da liberação de acetilcolina52 em resposta a um impulso nervoso.
As terminações nervosas da junção neuromuscular55 não mais respondem aos impulsos nervosos e a liberação de quimiotransmissores é impedida (denervação53 química). A transmissão do impulso é restabelecida em duas etapas: (1) a proliferação nervosa dos neurônios56 afetados estabelece uma conexão temporária e (2) a placa57 motora terminal original é reativada.
Quando injetado por via intradérmica, BOTOX® produz denervação53 química temporária da glândula58 sudorípara resultando em redução local do suor.
BOTOX® também bloqueia a liberação de neurotransmissores associados com a origem da dor. O mecanismo presumido para profilaxia de migrânea21 é o bloqueio de sinais59 periféricos para o sistema nervoso central60, que inibe a sensibilização central, conforme confirmado em estudos pré-clínicos e clínicos.
Pela via intradetrusora BOTOX® age na atividade do detrusor pelas vias eferentes61 com a inibição da liberação de acetilcolina52. Além disso, BOTOX® inibe os neurotransmissores aferentes e as vias sensoriais.
Farmacocinética
Estudos de distribuição em ratos indicam difusão muscular mínima de 125I-complexo de neurotoxina no músculo gastrocnêmico após injeção27, seguido de rápido metabolismo62 sistêmico63 e excreção urinária. A meia-vida de 125I-complexo de neurotoxina foi de aproximadamente 10 horas. A toxina1 é, provavelmente, metabolizada por proteases e os componentes moleculares ciclicamente através de vias metabólicas normais. Estudos clássicos de absorção, distribuição, metabolismo62 e eliminação da substância ativa não foram realizados devido à natureza do produto.
CONTRAINDICAÇÕES
Este medicamento é contraindicado em pessoas com antecedentes hipersensibilidade a qualquer dos ingredientes contido na formulação e na presença de infecção64 no local da aplicação.
É contraindicado, para o tratamento de disfunções da bexiga17, no caso de:
- pacientes com infecção64 do trato urinário65 no momento do tratamento;
- pacientes com retenção urinária aguda66 no momento do tratamento, não cateterizados;
Este medicamento é contraindicado para menores de 2 anos.
ADVERTÊNCIAS E PRECAUÇÕES
A eficácia e segurança de BOTOX® dependem do armazenamento adequado do produto, seleção correta da dose e técnicas apropriadas de reconstituição e administração. Os profissionais de saúde7 que fizerem uso de BOTOX® em seus pacientes devem entender profundamente de anatomia neuromuscular topográfica e funcional das regiões a serem tratadas, bem como estar a par de quaisquer alterações anatômicas que tenham ocorrido com o paciente devido a procedimentos cirúrgicos anteriores. Devem conhecer também técnicas-padrão de eletromiografia67 ou de eletroestimulação68. Eventos adversos graves foram reportados por pacientes que receberam BOTOX® diretamente nas glândulas salivares69, na região oro-lingual-faríngea, esôfago70 e estômago71. Alguns pacientes possuíam disfagia72 pré-existente ou debilidade significante. Pneumotórax73 associado ao procedimento foi relatado após a administração de BOTOX® próximo ao tórax74. Deve-se ter precaução ao injetar próximo ao pulmão75, particularmente nos ápices. Precaução deve ser tomada na utilização de BOTOX® na presença de inflamação76 no local da injeção27, quando há fraqueza excessiva ou atrofia54 do músculo alvo.
Conforme esperado para qualquer procedimento injetável, pode ocorrer: dor localizada, inflamação76, parestesia77, hipoestesia78, sensibilidade, inchaço79/ edema80, eritema81, infecção64 localizada, sangramento e/ou hematoma82. Relacionadas com a agulha: dor e/ ou ansiedade tem resultado em respostas vasovagal incluindo hipotensão83 sintomática84 transitória e síncope85.
Reações de Hipersensibilidade
Reações sérias e ou imediatas de hipersensibilidade como anafilaxia86 e doença do soro87 foram raramente reportadas, assim como outras formas de manifestação de hipersensibilidade como urticária88, edema80 de partes moles e dispneia89. Algumas destas reações foram reportadas após a administração de BOTOX®, isoladas ou em conjunto com a associação a outros produtos que apresentam reações similares. Se uma destas reações ocorrer, a aplicação deste produto deve ser descontinuada e uma terapia apropriada deve ser instalada imediatamente. Um caso fatal de anafilaxia86 foi reportado, no qual o paciente morreu após receber uma injeção27 de BOTOX® inapropriadamente diluído com 5ml de lidocaína a 1%. O envolvimento de BOTOX®, da lidocaína ou ambos neste caso não pode ser determinado com segurança.
Doenças neurológicas pré-existentes
Extrema precaução deve ser tomada quando da administração de BOTOX® em indivíduos portadores de doenças neurológicas envolvendo o neurônio motor periférico (ex.: esclerose90 lateral amiotrófica ou neuropatia91) ou em patologias da junção neuromuscular55 (ex.: miastenia92 gravis, Síndrome93 de Lambert- Eaton). Pacientes com desordens na junção neuromuscular55 podem aumentar o risco de efeitos sistêmicos94 clinicamente significantes, incluindo disfagia72 severa e comprometimento respiratório com doses habituais de BOTOX®. Já houve raros casos de administração de toxina1 botulínica em pacientes com patologia95 da junção neuromuscular55 conhecidas ou não reconhecidas onde os mesmos mostraram uma extrema sensibilidade com efeitos indesejáveis sistêmicos94 em doses habituais. Em alguns casos, a disfagia72 perdurou por vários meses e foi necessária a introdução de alimentação parenteral. Quando expostos a doses muito altas, pacientes com doenças neurológicas como paralisia35 cerebral pediátrica ou adultos com espasticidade12, também podem aumentar o risco de efeitos clínicos sistêmicos94 significativos.
Efeitos adversos a distância do ponto de injeção27
Dados de segurança pós-comercialização de BOTOX® e de outras toxinas6 botulínicas aprovadas sugerem que os efeitos da toxina1 botulínica podem, em alguns casos, ser observados à distância do ponto de injeção27. Os sintomas18 que são consistentes com o mecanismo de ação descrito para a toxina1 botulínica foram reportados de horas a semanas após a injeção27, e podem incluir fraqueza muscular, ptose96, diplopia97, visão98 borrada, flacidez facial, desordens de deglutição99 e fala, constipação100, aspiração, pneumonia101, dificuldade respiratória e depressão respiratória. Os riscos destes sintomas18 são provavelmente aumentados em crianças tratadas para espasticidade12, mas os sintomas18 podem também aparecer em outros pacientes tratados por outras condições ou com comorbidades102 que poderiam os predispor a estes sintomas18, incluindo adultos tratados para espasticidade12 ou outras condições com altas doses. Dificuldades de deglutição99 e respiração podem levar a risco de vida e já foi reportada morte apesar de não se conseguir estabelecer uma relação de causa-efeito definitivamente associada a BOTOX®. Pacientes necessitam ser advertidos para procurar auxilio médico imediato na vigência de dificuldade de deglutição99, fala ou dificuldade respiratória.
Sistema cardiovascular103
Houveram casos reportados após a administração de toxina1 botulínica, de efeitos adversos envolvendo o sistema cardiovascular103, incluindo arritmia104 e infarto do miocárdio105, com alguns desfechos fatais. Alguns destes pacientes possuíam risco cardíaco incluindo doença cardiovascular pré-existente. A exata relação destes eventos com BOTOX® continua desconhecida.
Convulsões
Novas ocorrências e recorrências106 de convulsões têm sido reportadas, tipicamente em pacientes predispostos a este tipo de evento. A exata relação deste evento com a injeção27 de toxina1 botulínica não foi estabelecida. Os casos reportados foram predominantemente em crianças com paralisia35 cerebral tratados devido a espasticidade12.
Imunogenicidade
A formação de anticorpos47 neutralizantes para a toxina1 botulínica pode reduzir a efetividade do tratamento com BOTOX® pela inativação da atividade biológica da toxina1. O fator crítico para a formação de anticorpos47 neutralizantes não foi ainda bem caracterizado. O potencial de formação de anticorpos47 neutralizantes pode ser minimizado pela injeção27 da menor dose efetiva com o intervalo mais longo possível entre as injeções.
Albumina2 Humana
Este produto contém albumina2 sérica humana, um derivado do sangue107 humano. Graças a uma triagem efetiva dos doadores e dos processos de fabricação do produto, é extremamente remota a possibilidade de transmissão de alguma doença viral. O risco teórico da transmissão da doença de Creutzfeldt-Jakob (CJD) também é considerado extremamente remoto. Nenhum caso de transmissão de doença viral ou de CJD foi identificada como tendo sido transmitida através da albumina2.
Precauções e advertências gerais por indicação
Blefaroespasmo25 / Espasmo11 Hemifacial: Redução do ato de piscar após a injeção27 de BOTOX® no músculo orbicular dos olhos108 pode levar a uma exposição da córnea109, defeito epitelial permanente e ulceração110 da córnea109 especialmente em pacientes com desordens do VII par craniano10. Um caso de perfuração da córnea109 em um olho28 nesta circunstância exigiu a enxertia de córnea109. Um teste cuidadoso da sensibilidade corneal nos olhos108 antes do procedimento é recomendado, assim como evitar-se a injeção27 na porção média da linha ciliar para se evitar o ectrópio111, e aplicar tratamento vigoroso para qualquer efeito epitelial da aplicação. Isto pode requerer curativos protetores, lentes de contato ou curativos oclusivos do olho28. Devido a atividade anticolinérgica da toxina1 botulínica, cuidado extra deve ser tomado quando pacientes com risco de glaucoma112 forem tratados, incluindo pacientes de ângulos anatômicos estreitos.
Bexiga17 Hiperativa (neurogênica ou idiopática31): Precaução médica apropriada deve ser dedicada à realização de uma citoscopia. Em pacientes que não estão em regime de cateterismo113 vesical114, o volume residual115 de urina116 deve ser avaliado dentro de 2 semanas após o tratamento, e, periodicamente por até 12 semanas. Os pacientes devem ser orientados a contatar o médico se sentirem dificuldades no esvaziamento vesical114 pois pode ser necessário uma cateterização. Devido ao risco de retenção urinária117, somente os pacientes que estão aptos à cateterização após tratamento, se necessário, devem ser considerados. Disreflexia autonômica118 associada ao procedimento pode ocorrer e, neste caso, assistência médica imediata pode ser requerida.
Estrabismo8: BOTOX® não é efetivo no estrabismo8 paralítico crônico119, exceto para reduzir a contratura ao antagonista120 em conjunto com a correção cirúrgica. A eficácia de BOTOX® em desvios de mais de 50 dioptrias, no estrabismo8 restritivo, na Síndrome93 de Duane com fraqueza do reto121 lateral, e no estrabismo8 secundário causado por cirurgia pregressa com excesso de redução do antagonista120 é duvidosa. De modo a comprovar a eficiência, múltiplas injeções ao longo do tempo podem ser requeridas.
Durante a administração de BOTOX® para o tratamento do estrabismo8, podem ocorrer hemorragias122 retro-bulbares suficientes para comprometer a circulação123 da retina124 que ocorreram pela penetração da agulha da órbita. É recomendado que instrumental apropriado esteja disponível e seja utilizado para o exame e descompressão125 da órbita. A penetração do globo ocular126 pelas agulhas também pode ocorrer. Um oftalmoscópio para o diagnóstico127 desta ocorrência deve estar disponível.
Induzir a paralisia35 em um ou mais músculos38 extraoculares pode provocar uma desorientação espacial, visão98 dupla, ou dificuldade de localização de distâncias. Cobrir o olho28 afetado pode aliviar estes sintomas18.
Distoniacervical: Disfagia72 é um evento adverso comumente relatado após o tratamento em pacientes com distonia9 cervical para todos os tipos de toxinas6 botulínicas. Pacientes com distonia9 cervical devem ser informados da possibilidade de experimentarem disfagia72 que pode ser leve ou grave. A disfagia72 pode persistir por duas ou três semanas após a injeção27, mas tem sido relatado até cinco meses após a injeção27. Consequente à disfagia72 pode ocorrer potencialmente aspiração, disfonia128 e ocasionalmente a necessidade de se instalar alimentação parenteral por sonda nasogástrica129. Em casos raros, já foi descrito que a disfagia72 foi seguida de pneumonia101 aspirativa e morte. Injeções no músculo elevador da escápula130 podem estar associadas com o aumento do risco de infecção64 respiratória e disfagia72.
A disfagia72 tem contribuído para o decréscimo da ingestão de água e comida, resultado em perda de peso e desidratação131. Pacientes com disfagia72 sub-clinica podem ter um risco aumentado de experimentar uma disfagia72 mais grave após uma nova injeção27 de BOTOX®.
Limitar a dose injetada no músculo esternocleidomastoideo132 para menos de 100U pode diminuir a ocorrência de disfagia72. Tem sido reportados como tendo maior risco de desenvolver quadros de disfagia72, pacientes com pequena massa muscular cervical ou pacientes que recebem tratamento bilateralmente sobre os músculos38 esternocleidomastoideos. A disfagia72 é atribuída a uma difusão local da toxina1 em direção a musculatura esofageal.
Pacientes e assistentes devem ser advertidos para procurar cuidados médicos imediatos aos sintomas18 de dificuldade de deglutição99, fala ou respiração.
Espasticidade12: BOTOX® é indicado para o tratamento da espasticidade12 focal e, neste caso, apenas foi estudado em associação com os esquemas padrão de cuidados. BOTOX® não é eficaz para melhorar a amplitude de movimento em articulação133 afetada por uma contratura sabidamente fixa.
Houve raros relatos espontâneos de morte algumas vezes associados a pneumonia101 aspirativa em crianças com paralisia35 cerebral grave após o tratamento com toxina1 botulínica. Uma associação causal com BOTOX® nestes casos não foi estabelecida. Alguns destes pacientes apresentavam fatores de risco incluindo excessiva debilidade neuromuscular, disfagia72, pneumonia101 aspirativa, convulsões e doenças cardiovasculares134. Relatos pós-comercialização sobre possível efeito da toxina1 em pontos distantes da injeção27 foram raramente reportados em pacientes pediátricos com co-cobirdades, principalmente em crianças portadoras de paralisia35 cerebral que receberam doses >8 U/kg. Cuidado deve ser tomado quando tratamos pacientes com significativa debilidade neuromuscular, disfagia72, com história de pneumonia101 aspirativa ou doença pulmonar.
Migrânea21 Crônica: BOTOX® é indicado para a profilaxia das enxaquecas22 crônicas e refratárias23 com comprometimento importante da qualidade de vida e das atividades diárias (laborativas, sociais, familiares e de lazer). BOTOX® não está indicado na enxaqueca49 e outros tipos de cefaleias135 crônicas e diárias como: cefaleias135 do tipo tensional crônica, cefaleia48 cervicogênica, hemicraniana contínua e cefaleia48 persistente e diária.
Hiperidrose13: Causas secundárias de hiperidrose13 (por exemplo, hipertireoidismo136 e feocromocitoma137) devem ser consideradas para evitar o tratamento da hiperidrose13 sem o diagnóstico127 e/ou tratamento da doença de base.
Linhas faciais hipercinéticas: Redução do ato de piscar após a injeção27 de BOTOX® no músculo orbicular dos olhos108 pode levar a uma exposição da córnea109, defeito epitelial persistente e ulceração110 de córnea109 especialmente em pacientes com lesão43 do VII par craniano10. Cuidado deve ser tomado quando se utilizar BOTOX® em pacientes com inflamação76 no local da injeção27, marcada assimetria facial, ptose96, dermatocalásio excessivo, cicatrizes138 dérmica profundas, pele139 sebácea espessa ou substancial inabilidade de diminuição das linhas glabelares devido ao distanciamento físico entre elas.
Precauções e advertências para populações especiais
Uso em Idosos
Geralmente os estudos clínicos de BOTOX® não identificaram diferenças nas respostas aos tratamentos com indivíduos com idade acima de 65 anos dos indivíduos mais jovens. De modo geral, a escolha da dose para pacientes37 idosos requer cuidado, recomendando-se iniciar com a dose mais baixa.
Uso Pediátrico
BOTOX® pode ser utilizado em crianças com paralisia35 cerebral sendo que a posologia deve ser adaptada ao peso corporal (ver Posologia). A segurança e eficácia de BOTOX® não foram estabelecidas em crianças, abaixo de 2 anos de idade, portadoras de paralisia35 cerebral; em crianças abaixo de 12 anos de idade para blefaroespasmo25, espasmo11 hemifacial, estrabismo8 ou hiperidrose13; em pacientes abaixo de 16 anos para distonia9 cervical; em pacientes abaixo de 18 anos para espasticidade12, migrânea21 crônica, tratamento da hiperatividade da bexiga17 por incontinência urinária15 ou hiperatividade neurogênica do músculo detrusor16 da bexiga17 e linhas faciais hipercinéticas.
Uso durante a Gravidez140
Gravidez140 categoria C. Não há estudos adequados sobre a administração de BOTOX® em mulheres durante a gravidez140. Considerando que os estudos em animais nem sempre são preditivos de resposta humana, BOTOX® somente deve ser administrado durante a gravidez140 se os potenciais benefícios justificarem o potencial risco para o feto141. Se este medicamento for utilizado durante a gestação, ou se a mulher engravidar durante o tratamento, a paciente deve ser advertida quanto aos potenciais riscos. Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião dentista.
Uso durante a Amamentação142
Não existem dados disponíveis sobre a excreção desta droga pelo leite humano. O uso de BOTOX® durante o aleitamento não é recomendado.
Carcinogênese, Mutagênese, Diminuição da Fertilidade
BOTOX® não se mostrou seletivamente tóxico para o embrião ou feto141 nas espécies estudadas. Efeitos maternos observados foram, principalmente devido às ações farmacológicas previstas de BOTOX®. Efeitos sobre o desenvolvimento (peso corporal diminuído, ossificação retardada) em camundongos, ratos e coelhos foram observadas em doses que variavam de 0,5 a 8 Un/kg dependendo do esquema de injeções diárias ou periódico adotado.
Efeitos sobre a habilidade de dirigir automóvel e utilizar máquinas
Astenia143, fraqueza muscular, tontura144, distúrbios visuais foram reportados após o tratamento com BOTOX®, podendo tornar perigoso o ato de dirigir ou usar máquinas.
INTERAÇÕES MEDICAMENTOSAS
O efeito da toxina1 botulínica pode ser potencializado por antibióticos aminoglicosídeos ou quaisquer outras drogas que interfiram com a transmissão neuromuscular (por exemplo, agentes bloqueadores neuromusculares). Testes específicos não foram conduzidos para estabelecer interações medicamentosas com outros produtos. Não foram reportadas interações medicamentosas clínicas significativas.
O efeito da administração de diferentes sorotipos de neurotoxina botulínica ao mesmo tempo ou com muitos meses de intervalo entre elas é desconhecido. A fraqueza excessiva pode ser piorada com a administração de outra toxina1 botulínica antes do término dos efeitos da toxina1 botulínica administrada previamente.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Em sua embalagem intacta, BOTOX® pode ser conservado tanto em freezer em temperatura de - 5ºC ou inferior, ou em geladeira entre 2º e 8º C.
O prazo de validade de BOTOX® encontra-se impresso na embalagem do produto. Número de lote, data de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Após preparo, manter sob refrigeração (2°C a 8°C) por até 3 dias.
Características físicas e organolépticas do produto
BOTOX® é um pó seco congelado a vácuo. Após reconstituição, a solução deve ser livre de partículas.
Antes de usar, observe o aspecto do medicamento.
Todo medicamento deve ser mantido fora do alcance das crianças.
POSOLOGIA E MODO DE USAR
DEVE SER APLICADO SOMENTE POR PROFISSIONAL DE SAÚDE7 DEVIDAMENTE QUALIFICADO PARA USO CORRETO DO PRODUTO E EQUIPAMENTOS NECESSÁRIOS.
Antes de utilizar o medicamento, confira o nome no rótulo, para não haver enganos. Não utilize BOTOX® caso haja sinais59 de violação e/ou danificações no lacre do frasco-ampola.
Técnica de Diluição
Para reconstituir BOTOX® congelado a vácuo estéril, utilizar solução salina – 0,9% de cloreto de sódio sem conservantes, estéril, injetável.
Aspirar a quantidade necessária de diluente com a seringa145 apropriada. Injetar o diluente no frasco lentamente, misturando delicadamente (ver tabelas de diluição). Não utilizar o frasco se não houver vácuo, ou seja, quando o vácuo não aspirar o diluente para dentro do frasco. Nestes casos consultar a Allergan para correta investigação e procedimentos necessários. Anotar a data e a hora de reconstituição no espaço reservado no rótulo do frasco.
BOTOX® deve ser administrado dentro de 3 dias (72 horas) após a reconstituição. BOTOX® reconstituído deve ser uma solução clara, livre de partículas. Produtos parenterais devem ser inspecionados visualmente para detecção de partículas e alterações de coloração antes da administração.
Somente utilizar seringas e agulhas estéreis cada vez que fizer necessária a diluição ou retirada de BOTOX® do frasco.
Tabela de Diluição para frascos de 50 Unidades, 100 Unidades, e 200 Unidades
|
Diluente adicionado (cloreto de sódio a 0,9%) |
Frasco de 50U |
Frasco de 100U |
Frasco de 200U |
|
Dose Resultante |
Dose Resultante |
Dose Resultante |
|
|
0.5 mL |
10 |
20 |
40 |
|
1 mL |
5 |
10 |
20 |
|
2 mL |
2.5 |
5 |
10 |
|
2,5 mL |
2 |
4 |
8 |
|
4 mL |
1.25 |
2.5 |
5 |
|
8 mL |
NA |
1.25 |
2.5 |
|
10 mL |
NA |
1 |
2 |
Nota: Essas diluições são calculadas para uma aplicação com volume de 0,1ml. Um aumento ou diminuição na dose de BOTOX® é também possível com a administração de um volume maior ou menor, de 0,05 ml (50% a menos em uma dose) a 0,15 ml (50% a mais em uma dose).
Reconstituição de BOTOX® para bexiga17 hiperativa
Reconstituir um frasco de BOTOX® 100 unidades com 10 ml de solução salina a 0.9% sem conservantes misturando gentilmente (ver tabela de diluição).
O volume total obtido será de 10 ml contendo 100U de BOTOX®.
Reconstituição de BOTOX® para bexiga17 hiperativa neurogênica
Sugestão 1: Reconstituir um frasco de 200U de BOTOX® com 6 mL de solução salina 0,9% e misturar gentilmente. Passar 2 mL do frasco para cada uma das três seringas de 10 mL. Completar a reconstituição adicionando 8 mL de solução salina 0,9% em cada uma das três seringas de 10 mL e misturar gentilmente. O volume obtido será de três seringas contendo 10 mL (~67U/cada), para um total de 200U de BOTOX® reconstituído. Utilizar imediatamente após a reconstituição na seringa145.
Sugestão 2: Reconstituir dois frascos de 100U de BOTOX®, adicionando 6 mL de solução salina 0,9% em cada um e misturar gentilmente. Passar 4 mL de cada um dos frascos para duas seringas de10 mL. Passar os 2 mL restantes de cada um dos frascos para uma terceira seringa145 de 10 mL. Completar a reconstituição adicionando 6 mL de solução salina 0,9% em cada uma das três seringas de 10 mL e misturar gentilmente. O volume obtido será de três seringas contendo 10 mL (~67U/cada), para um total de 200U de BOTOX® reconstituído.
Técnica de Manuseio
A injeção27 de BOTOX® é preparada aspirando-se a toxina1 diluída do frasco, em quantidade suficiente e ligeiramente superior à dose desejada. As bolhas de ar na seringa145 devem ser expelidas e a seringa145 deve ser conectada à agulha selecionada. O volume excedente é expelido através da agulha para um recipiente de sobras, a fim de assegurar a desobstrução da agulha e confirmar que não há vazamento na junção seringa145-agulha.
Para injetar no paciente podem-se utilizar agulhas calibre 25 a 30 para alguns tipos de músculos38. Pode ser útil a localização dos músculos38 envolvidos por eletromiografia67 ou por técnicas de estimulação elétrica dos nervos.
Via de Administração
Para redução da sudorese146 na hiperidrose13, a via é intradérmica e para obtenção de relaxamento muscular nas demais indicações a via é intramuscular. Em determinadas situações o uso da eletromiografia67 ou técnica da eletroestimulação68 dos músculos38, pode auxiliar na localização apropriada do músculo a ser injetado.
Para tratamento da incontinência urinária15 causada por bexiga17 hiperativa, a via de administração é intramuscular, no músculo detrusor16 da bexiga17 com auxílio de cistoscopia147.
Orientação para Descarte
Todos os frascos usados e os equipamentos utilizados devem ser cuidadosamente descartados, conforme é normalmente realizado com todos os detritos de origem médica.
Posologia
As doses recomendadas para BOTOX® - não são apropriadas para uso com outras preparações/ marcas comerciais de toxina1 botulínica.
O método de administração depende das características individuais do paciente, da indicação, da localização e da extensão do comprometimento dos grupos musculares envolvidos.
Níveis de doses ótimas e números de pontos de injeção27 por músculo não foram ainda estabelecidos para todas as indicações. A dose exata e o número de pontos de injeção27 devem ser adaptados às necessidades dos pacientes baseado no tamanho, número e localização dos músculos38 a serem tratados, severidade da doença e presença de fraqueza muscular frente a resposta individual dos pacientes em tratamentos prévios e condição médica do paciente.
Como em qualquer tratamento, deve se iniciar com a menor dosagem recomendada. A dose pode ser aumentada gradualmente em tratamentos subsequentes até a dose máxima indicada, se necessário. Os intervalos entre as injeções de BOTOX® geralmente, não devem ser mais frequentes do que a cada três meses. Dosagem, indicação e recomendações de administração devem ser seguidas. Embora não existam dados clínicos controlados disponíveis para tratamentos simultâneos de múltiplas indicações, como uma consideração de ordem prática, no tratamento de pacientes adultos, a dose cumulativa máxima geralmente não deve ultrapassar 400 unidades, em um intervalo de três meses. No tratamento de pacientes pediátricos, a dose cumulativa geralmente não deve exceder 8 U / kg ou 300 unidades, num intervalo de 3 meses. Os resultados clínicos, incluindo os riscos, na utilização de doses mais altas em todos os grupos de tratamento não são bem estabelecidos.
Posologia por indicação
Blefarospasmo
A dose inicial recomendada varia de 1,25U a 2,5U, injetada nas regiões medial e lateral do músculo orbicular da pálpebra superior e região lateral do músculo orbicular da pálpebra inferior. Geralmente, o início da ação se manifesta dentro de 3 dias e atinge o pico máximo de uma a duas semanas após a aplicação. O efeito do tratamento dura aproximadamente três meses, e pode ser repetido quando necessário. A dose cumulativa de BOTOX® no período de 2 meses não deve exceder 200 unidades. Evitando a injeção27 próxima ao elevador da pálpebra superior, pode-se reduzir a possibilidade de aparecer ptose96 como complicação. Evitando a injeção27 na pálpebra inferior média, e, assim reduzindo a difusão para o músculo oblíquo inferior, pode-se reduzir a possibilidade de aparecer diplopia97 como complicação. Pode ocorrer equimose148 nos tecidos da pálpebra, o que pode ser reduzido aplicando-se uma pequena pressão no local da injeção27 imediatamente após a aplicação.
A dose inicial não deve exceder 25U por olho28. Nas sessões de repetição de tratamento, a dose pode ser aumentada até o dobro da dose previamente administrada se a resposta do tratamento inicial for considerada insuficiente (definida como um efeito que dura pouco, menos que dois meses). Por outro lado, na maioria das situações parece que o benefício é mínimo com a injeção27 de mais de 5U por ponto de injeção27.
Espasmo11 hemifacial
Pacientes com espasmo11 hemifacial ou distúrbio do VII par craniano10 devem ser tratados do mesmo modo descrito para o blefarospasmo unilateral. Injeções adicionais podem ser necessárias no corrugador, zigomático maior, orbicular da boca149, e/ou outros músculos38 conforme a extensão do espasmo11.
A dose cumulativa de BOTOX® no período de 2 meses não deve exceder 200 unidades.
Estrabismo8
BOTOX® foi desenvolvido para administração nos músculos38 extraoculares, utilizando a atividade elétrica obtida através da ponta da agulha injetável, como guia para a aplicação no músculo desejado. Para preparar o olho28 para a aplicação, recomenda-se a aplicação de várias gotas de um anestésico local e um descongestionante que devem ser aplicados alguns minutos antes da injeção27 de BOTOX®.
Doses iniciais em unidades (abreviação = U): Usar a dose mais baixa para desvios menores. Usar doses superiores somente com desvios maiores.
- Para músculos38 verticais, e para estrabismo8 horizontal inferior a 20 dioptrias: 1,25U a 2,5U em qualquer músculo.
- Para estrabismo8 horizontal de 20 dioptrias a 50 dioptrias: 2,5U a 5,0U em qualquer músculo.
- Para paralisia35 persistente do VI par craniano com um mês ou mais de duração: 1,25U a 2,5U no músculo reto121 medial.
As doses iniciais de BOTOX® promovem a paralisia35 dos músculos38 injetados, um a dois dias após a aplicação, aumentando em intensidade durante a primeira semana. A paralisia35 dura de 2 a 6 semanas e gradualmente desaparece em um período de tempo equivalente. Supercorreções com duração superior a 6 meses têm sido raras.
Doses subsequentes para estrabismo8 recorrente ou residual.
Cerca de metade dos pacientes requerem doses subsequentes devido à resposta paralítica inadequada do músculo à dose inicial ou devido a fatores mecânicos, tais como desvios grandes ou limitações, ou devido à ausência de fusão motora binocular para estabilizar o alinhamento. Recomenda-se que os pacientes sejam re-examinados, entre 7 a 14 dias após cada injeção27, para verificar os resultados de efeito da dose. Pacientes apresentando paralisia35 adequada do músculo desejado e que requerem injeções subsequentes, devem receber uma dose comparável à dose inicial.
Para pacientes37 com paralisia35 incompleta do músculo desejado, as doses adicionais podem ser até duas vezes maiores que a dose inicial administrada previamente. Injeções subsequentes não devem ser administradas até que os efeitos da dose anterior tenham sido dissipados, o que é demonstrado pela movimentação dos músculos38 injetados ou adjacentes a esse.
A dose máxima recomendada para qualquer músculo é de 25U. Recomenda-se que a variação de volume para todas as aplicações referentes a estrabismo8 situe-se entre 0,05 ml a 0,15 ml por músculo.
Espasticidade12
Espasticidade12 associada ao acidente vascular cerebral150: Em estudos científicos clínicos abertos e controlados as doses utilizadas para músculos38 individualizados chegaram a 400U, como dose total, por sessão de tratamento. Em estudos abertos controlados e não controlados, usualmente foram utilizadas 200-240 unidades no punho e músculos38 flexores divididas entre os músculos38 selecionados e tratados em cada sessão de tratamento.
Em estudos clínicos controlados, a melhora no tônus muscular151 ocorre com duas semanas com o pico de efeito geralmente visto entre a quarta e a sexta semana. Em trabalhos abertos, não controlados de seguimento muitos pacientes são re-injetados após um intervalo de 12 a 16 semanas, quando os efeitos sobre o tônus muscular151 diminuem. Estes pacientes recebem até quatro injeções com uma dose cumulativa máxima de 960 unidades durante 54 semanas. Se for considerado apropriado pelo médico, a repetição da dose pode ser administrada quando os efeitos da injeção27 anterior tiverem diminuído. Re-injeções não devem ser realizadas com intervalo menor que 12 semanas. O grau e o padrão muscular de espasticidade12 na hora da re-injeção27 poderão ditar a necessidade de alteração das doses de BOTOX® e dos músculos38 a serem injetados. A menor dose efetiva deve ser utilizada.
A seguir é apresentada a orientação geral de doses para a injeção27 de BOTOX® (no tratamento da espasticidade12 dos membros superiores associada ao acidente vascular cerebral150 ou traumatismo152 craniano):
|
Músculo |
Dose total; Número de pontos de injeção27 |
|
Bíceps braquial |
100 – 200U; 1-4 pontos |
|
Flexor profundo dos dedos |
15 – 50U; 1 –2 pontos |
|
Flexor superficial dos dedos |
15 – 50U; 1 –2 pontos |
|
Flexor radial do carpo |
15 – 60U; 1 –2 pontos |
|
Flexor ulnar do carpo |
10 – 50U; 1 –2 pontos |
|
Adutor do polegar |
20U; 1 –2 pontos |
|
Flexor longo do polegar |
20U; 1 –2 pontos |
Espasticidade12 relacionada à paralisiacerebral (pediátrica): A identificação das metas de tratamento e da responsabilidade específica dos músculos38 nos padrões espásticos necessitam ser determinadas antes da injeção27 de BOTOX®. É necessário o exame clinico dos músculos38 em um padrão de espasticidade12 focal e o uso da eletroneuromiografia, ultrassonografia153 ou eletroestimulação68 pode ajudar na acuracidade do procedimento.
Em estudos clínicos para o tratamento de membros superiores a dose por músculo variou de 0.5-2U/Kg de peso corporal e de 2.0-4.0U/Kg de peso corporal para membros inferiores por sessão de tratamento. Para o tratamento da deformidade em pé equino, a dose média varia de 2.0-4.0U/Kg por sessão de tratamento. A dose total foi de 4.0U/Kg ou 200U (o que é uma pequena quantidade) dividida nos pontos de aplicação do músculo gastrocnêmio36 lateral e medial154 de uma ou ambas as pernas. No seguimento dos resultados de um injeção27 no músculo gastrocnêmio36, um possível envolvimento dos músculos38 tibial anterior e posterior pode ser visto e assim surgir a necessidade de um tratamento adicional no sentido de melhorar a posição do pé e do tornozelo155 na fase de balanço e apoio da marcha.
A Tabela abaixo recomenda as doses para a injeção27 de BOTOX® no tratamento da espasticidade12 focal em crianças acima de 2 anos de idade. A dose máxima cumulativa não deve exceder 8U/Kg de peso corporal ou 300U divididas entre os músculos38 a serem tratados em qualquer sessão de tratamento ou intervalos de 3 meses.
|
Músculos38 do membro superior |
Dosagem em unidades/kg/músculo |
Número de injeções por músculo |
|
Bíceps braquial |
0.5 - 2.0 |
2-4 pontos |
|
Braquial |
0.5 - 2.0 |
1-2 pontos |
|
Braquioradial |
0.5 - 2.0 |
1-2 pontos |
|
Flexor ulnar do carpo |
0.5 - 2.0 |
1-2 pontos |
|
Flexor radial do carpo |
0.5 - 2.0 |
1-2 pontos |
|
Pronador redondo |
0.5 - 2.0 |
1-2 pontos |
|
Pronador quadrado |
0.5 - 2.0 |
1-2 pontos |
|
Flexor profundo dos dedos |
0.5 - 2.0 |
1 ponto |
|
Flexor superficial dos dedos |
0.5 - 2.0 |
1 ponto |
|
Flexor longo do polegar |
0.5 - 2.0 |
1 ponto |
|
Flexor curto do polegar |
0.5 - 2.0 |
1 ponto |
|
Oponente do polegar |
0.5 - 2.0 |
1 ponto |
| Adutor do polegar | 0.5 - 2.0 | 1 ponto |
|
Músculos38 do membro inferior |
Dosagem em unidades/kg/músculo |
Número de injeções por músculo |
|
Adutores de quadril (adutor longo, adutor curto, adutor maior, isquiotibial medial) |
4.0 |
2 pontos |
|
Gastrocnêmio medial |
2.0 |
1-2 pontos |
|
Gastrocnêmio lateral |
2.0 |
1-2 pontos |
A melhora clínica geralmente ocorre dentro das duas primeiras semanas após a injeção27. A repetição das doses deve ser administrada quando os efeitos clínicos da doses anterior tiverem diminuído, mas tipicamente não antes de 3 meses de intervalo entre as injeções. O grau de espasticidade12 muscular na época da re-injeção27 poderá determinar a necessidade de alteração das doses de BOTOX® e dos músculos38 a serem injetados.
Distonia9
Distoniacervical: Têm sido utilizados vários esquemas posológicos, sendo que a dose deve ser titulada individualmente baseando-se na posição da cabeça156 e do pescoço157 do indivíduo, da localização da dor, da hipertrofia158 muscular, do peso do paciente, e da resposta do paciente em caso de repetição do procedimento. O tratamento da distonia9 cervical pode incluir, mas não é limitado a uma ou mais injeções de BOTOX® nos músculos38 esternocleidomastoideo132, elevador da escápula130, escaleno, esplênio da cabeça156, semiespinhal, longuíssimo e/ou trapézio159. Em caso de dificuldade para isolar os músculos38 do paciente, as injeções devem ser feitas por um profissional experiente e com a ajuda de técnicas de eletromiografia67. Em estudos clínicos controlados, as doses variaram entre 95U e 360U (com média aproximada de 240U). Assim como para qualquer medicamento, a dose inicial em um paciente comum deve corresponder à dose eficaz mais baixa possível. Não mais do que 50 unidades aplicadas em cada ponto de injeção27. Limitando-se o total de dose injetada no músculo esternocleidomastoide em 100U ou menos, pode-se diminuir a ocorrência de disfagia72. O numero ótimo de pontos de injeção27 é dependente do tamanho do músculo a ser injetado.
A melhora clínica geralmente ocorre dentro das duas primeiras semanas após a injeção27. O benefício clínico máximo geralmente ocorre aproximadamente em seis semanas após a injeção27. Intervalo de tratamento menor que 2 meses não é recomendado. A duração do efeito terapêutico relatado nos estudos clínicos apresentou variação substancial (de 2 a 32 semanas), com uma duração típica de aproximadamente 12 a 16 semanas, dependendo da doença e da resposta individual do paciente.
A dose cumulativa de BOTOX® para distonia9 cervical no período de 3 meses não deve exceder 360 unidades.
Hiperidrose13
Hiperidroseaxilar: A dose inicial recomendada é de 50U por área hiperidrótica de cada axila, injetadas em plano intradérmico com 2,5 a 5U por injeção27, distribuídas em múltiplos pontos (10 a 15) e distando 1-2 cm entre si. Estas doses e pontos são sugeridos para a diluição de 100U em 4 ml (ver tabela de diluição) de solução fisiológica160 0,9% sem conservantes. A área hiperidrótica pode ser determinada utilizando testes padronizados como o Teste de Minor (teste do iodo-amido). Cada dose é injetada aproximadamente a 2 mm de profundidade com a agulha angulada a 45° em relação à superfície da pele139, com o bisel voltado para cima, a fim de minimizar perdas e assegurar que a aplicação seja intradérmica.
A melhora clínica geralmente ocorre dentro da primeira semana após a injeção27. A duração média da resposta é de 6-8 meses quando realizados tratamentos repetidos > 4 tratamentos. A repetição da injeção27 de BOTOX® pode ser realizada quando os efeitos clínicos da primeira injeção27 declinarem e o médico considerar a necessidade do re-tratamento. As injeções não devem ser aplicadas com intervalos menores que 2 meses.
Hiperidrose13 palmar14: As injeções palmares podem ser dolorosas para alguns pacientes. A anestesia161 utilizada em estudos preliminares abertos publicados incluiu um creme anestésico tópico162, ou anestesia161 local, tal como bloqueio dos nervos ulnar e mediano.
A área a ser injetada deve ser definida utilizando técnicas padrão de coloração, como por exemplo, o teste de iodo-amido de Minor.
BOTOX® deve ser reconstituído com solução salina estéril a 0,9% sem conservantes com diluição sugerida de 2U/0,05 ml por ponto em plano intradérmico. A aplicação deve ser distribuída uniformemente por toda a área hiperidrótica distando 1-2 cm entre si com agulha calibre 30.
Em publicações de estudos preliminares, abertos, foram relatadas doses variando entre aproximadamente 50 a 150 Unidades por palma. A dose total por palma pode ser modificada com base no tamanho da mão163 e ou resultados de aplicações anteriores.
As injeções mais profundas, além das camadas subdérmicas, podem aumentar o risco de fraqueza muscular. Dispositivos pressurizados, sem agulhas (tais como o Dermojet®, Robins Instruments, Inc.) não são recomendados, pois podem diminuir a eficácia e podem causar efeitos colaterais164, tais como hematomas165 e/ou danos aos nervos locais.
A repetição das injeções para a hiperidrose13 palmar14 não devem ser feitas mais frequentemente do que a cada três meses.
Linhas Hipercinéticas ou de Expressão
BOTOX® deve ser reconstituído com solução salina estéril a 0,9% sem conservantes (50U/ 1,25ml ou 100U/ 2,5 ml) e injetado usando uma seringa145 estéril de 30 gauges em plano intramuscular. A dose e o número de pontos de injeção27 devem ser adaptados às necessidades dos pacientes, baseados em suas características e localização dos músculos38 a serem tratados.
Para reduzir a incidência166 de ptose96 como complicação, evitar a injeção27 próxima do músculo elevador da pálpebra superior. As injeções mediais no corrugador devem ser feitas pelo menos 1 cm acima da crista óssea supra-orbital. De modo geral não são recomendados intervalos menores que 3 meses entre as aplicações. A duração de efeito é de aproximadamente 3-4 meses na maioria dos pacientes. Há relatos de duração de efeitos de até 6 meses em alguns pacientes.
Bexiga17 hiperativa
Pacientes não devem estar na vigência de infecção64 urinária antes do tratamento. Antibiótico profilático poderá ser administrado 1 a 3 dias antes do tratamento, no dia do tratamento e por 1 a 3 dias subsequentes ou de acordo com a orientação do médico. É usualmente recomendada a suspensão de medicamento anti-agregante plaquetário pelo menos três dias antes da injeção27 intravesical. Pacientes em uso de terapia anti-coagulante deverão ser conduzidos adequadamente pelo médico assistente para evitar risco de hemorragia167.
Bexiga17 hiperativa idiopática31 (Tratamento da bexiga17 hiperativa com sintomas18 de incontinência19, urgência20 e aumento da frequência urinária): A dose recomendada é de 100U de BOTOX®. BOTOX® reconstituído (100 unidades/10 ml) é injetado por via intramuscular no músculo detrusor16 com o auxílio de um cistoscópio flexível ou rígido evitando o trígono. A bexiga17 deve ser instilada com solução salina suficiente para proporcionar visualização adequada para realizar as injeções.
Pode ser utilizado anestésico local (por exemplo, lidocaína) ou sedação168, para facilitar as injeções para aplicação intravesical de BOTOX®. O anestésico e tipo de anestesia161 devem ser administrados conforme rotina do especialista.
A agulha deve ser inserida no músculo detrusor16 com aproximadamente 2 mm de profundidade, e devem ser aplicadas 20 injeções de 0,5ml cada (totalizando um volume de 10 mL), com espaços de aproximadamente 1 cm entre elas (vide figura abaixo). Para a injeção27 final, aproximadamente 1 mL de solução salina normal deve ser injetada para que toda a dose seja aplicada. Depois da aplicação das injeções, a solução salina utilizada para visualização das paredes da bexiga17 não deve ser drenada para que o paciente possa demonstrar sua habilidade de micção42. O paciente deverá permanecer em observação por no mínimo 30 minutos após a injeção27 e até apresentar micção42 espontânea.
Melhoras clínicas podem ocorrer dentro de 2 semanas. A repetição da injeção27 de BOTOX® pode ser realizada quando os efeitos clínicos da primeira injeção27 declinarem e o médico considerar a necessidade do re-tratamento (a média de duração nos estudos clínicos de fase III foi de 166 dias [~24 semanas]) seguindo o intervalo o mais longo possível, e não devem ser aplicadas com intervalos menores que 3 meses. Baseado nos pacientes que reeberam tratamento apenas com BOTOX® 100U nos estudos pivotais durante a fase de extensão do estudo (N = 438), a duração média geral de resposta foi de ~212 dias (~30 semanas).
Bexiga17 hiperativa neurogênica (Incontinência urinária15 causada por bexiga17 hiperativa neurogênica): A dose recomendada é de 200U de BOTOX®. BOTOX® reconstituído (200 unidades/30 ml) é injetado por via intramuscular no músculo detrusor16 com o auxílio de um cistoscópio flexível ou rígido evitando o trígono. A bexiga17 deve ser instilada com solução salina suficiente para proporcionar visualização adequada para realizar as injeções.
Pode ser utilizado anestésico local (por exemplo, lidocaína) ou sedação168, para facilitar as injeções para aplicação intravesical de BOTOX®. O anestésico e tipo de anestesia161 devem ser administrados conforme rotina do especialista.
A agulha deve ser inserida no músculo detrusor16 com aproximadamente 2 mm de profundidade, e devem ser aplicadas 30 injeções de 1 ml cada (totalizando um volume de 30 mL), com espaços de aproximadamente 1 cm entre elas (vide figura abaixo). Para a injeção27 final, aproximadamente 1 mL de solução salina normal deve ser injetada para que toda a dose seja aplicada. Depois da aplicação das injeções, a solução salina utilizada para visualização das paredes da bexiga17 deve ser drenada. O paciente deverá permanecer em observação por no mínimo 30 minutos após a injeção27.
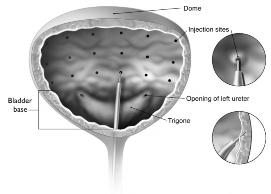
Melhoras clínicas podem ocorrer dentro de 2 semanas. A repetição da injeção27 de BOTOX® pode ser realizada quando os efeitos clínicos da primeira injeção27 declinarem e o médico considerar a necessidade do re- tratamento (a média de duração nos estudos clínicos de fase III foi de 256-295 dias [36 a 42 semanas] para BOTOX® 200U). As injeções devem obedecer o intervalo mais longo possível, e não devem ser aplicadas com intervalos menores que 3 meses.
Baseado nos pacientes que reeberam tratamento apenas com BOTOX® 200U nos estudos pivotais durante a fase de extensão do estudo (N = 174), a duração média geral de resposta foi de 253 dias (~36 semanas).
Profilaxia de migrânea21 crônica
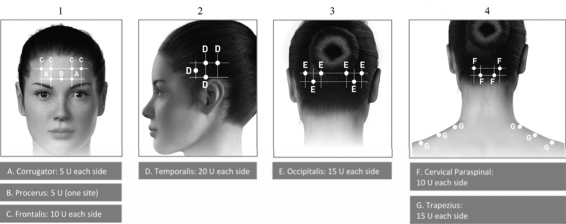
A diluição recomendada para tratamento profilático de migrânea21 crônica é de 100 unidades/ 2ml, com a concentração final de 5 unidades por 0,1ml. A dose recomendada de tratamento é de 155U a 195U administradas por via intramuscular (IM). As injeções devem ser distribuídas em 7 áreas musculares específicas da cabeça156/pescoço157 conforme especificado na Tabela abaixo.
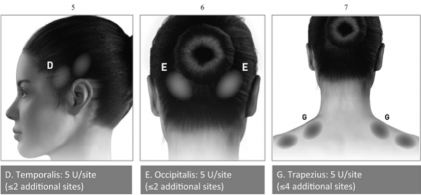
Uma agulha de 2,5 cm pode ser necessária para a região do pescoço157 para pacientes37 com pescoço157 grosso. Com exceção para o músculo procero, que pode ser injetado através de 1 ponto na região medial do músculo, todos os outros músculos38 devem ser injetados como indicado abaixo, com metade dos pontos aplicados à esquerda e metade à direita na cabeça156 e no pescoço157. A recomendação para os casos de re- tratamento é de 12 semanas. Se houver um ponto localizado de dor predominante, injeções adicionais de um ou ambos os lados podem ser administradas em até 3 grupos musculares específicos (occipital, temporal, e trapézio159), até a dose máxima de cada músculo como indica a tabela abaixo.
Pontos de aplicação para migrânea21 crônica:
Diagramas 1 – 4: Pontos de aplicações para dose mínima de 155 U dose para migrânea21 crônica.
Diagramas 5-7: Grupos musculares recomendados para injeções adicionais opcionais para migrânea21 crônica.
Dose requerida por local de aplicação nos músculos38 da cabeça156 e do pescoço157
|
Área muscular |
Número de Unidades por músculo |
||
|
Esquerdo |
Direito |
Total |
|
|
Frontal |
10U |
10U |
20U |
|
Corrugador |
5U |
5U |
10U |
|
Procero |
-- |
-- |
5U |
|
Occipital |
15U (3 locais) a |
15U (3 locais) a |
30U (6 locais) a |
|
Temporal |
20U (4 locais) a |
20U (4 locais) a |
40U (8 locais) a |
|
Trapézio159 |
15U (3 locais) a |
15U (3 locais) a |
30U (6 locais) a |
|
Grupo muscular |
10 U |
10 U |
20 U |
|
Total mínimo |
-- |
-- |
155U (31 locais) a |
a o volume da injeção27 em cada local deve ser de 0,1ml e a dose em cada local é de 5U de BOTOX.
REAÇÕES ADVERSAS
Reações Adversas Gerais
Em geral as reações adversas ocorrem dentro dos primeiros dias após a injeção27 e embora geralmente sejam transitórios, podem apresentar duração de vários meses, ou em raros casos, mais longa.
A fraqueza muscular representa uma ação farmacológica esperada da toxina1 botulínica no tecido169 muscular. Entretanto, também tem sido relatado fraqueza de músculos38 adjacentes e/ou músculos38 distantes, devido à difusão da toxina1.
Conforme esperado para qualquer procedimento injetável, dor no local de aplicação, inflamação76, parestesia77, hipoestesia78, sensibilidade anormal à compressão, intumescimento/edema80, eritema81, infecção64 localizada, hemorragia167 e/ou ardor170 foram associados com a injeção27. Dor não relacionada com a punção e/ou ansiedade, podem resultar em resposta vaso vagal, incluindo hipotensão83 sintomática84 transitória e síncope85.
Reações adversas – frequência por indicação
Os parâmetros de frequência das reações adversas para cada indicação são definidos como: Muito comum (> 1/10), Comum (> 1/100 e < 1/10), Incomum (> 1/1.000 e < 1/100), Rara (> 1/10.000 e < 1.000) e Muito rara (> 1/10.000).
Blefarospasmo/espasmo11 hemifacial
Os dados agrupados de estudos clínicos controlados e abertos envolvendo 1732 pacientes tratados com BOTOX® mostraram o relato das seguintes reações adversas:
- Muito Comum: ptose96 palpebral.
- Comuns: ceratite superficial puntiforme, lagoftalmos, olho28 seco, fotofobia171, irritação ocular, aumento de lacrimejamento e equimoses172.
- Incomuns: ceratite, ectrópio111, diplopia97, entrópio173, borramento de visão98, tontura144, erupção174 cutânea175, paralisia35 facial, cansaço.
- Raras: edema80 palpebral.
- Muito Raras: ceratite ulcerativa, defeito epitelial corneal, perfuração da córnea109.
Estrabismo8
Os dados de segurança obtidos dos estudos clínicos envolvendo 2058 pacientes tratados com BOTOX® mostraram o relato das seguintes reações adversas:
- Muito Comuns: ptose96 palpebral, distúrbios do movimento ocular.
- Incomuns: hemorragias122 retrobulbares, perfuração do olho28, pupila de Holmes-Adie. Raras: hemorragia167 vítrea.
- Distonia9 Cervical
Os dados de segurança obtidos dos estudos clínicos controlados com placebo24, duplo-mascarados, envolvendo 231 pacientes tratados com BOTOX® mostraram o relato das seguintes reações adversas:
- Muito Comuns: disfagia72, fraqueza muscular e dor local.
- Comuns: rinite176, infecção64 das vias aéreas superiores, tontura144, hipertonia177, hipoestesia78, sonolência, cefaleia48, boca149 seca, náusea178, rigidez musculoesquelética, astenia143, mal estar geral, síndrome93 gripal. Incomuns: dispneia89, diplopia97, febre179, ptose96 palpebral.
Paralisia35 cerebral pediátrica
Espasticidade12 dos membros superiores: foram relatados os seguintes eventos adversos em crianças tratadas para espasticidade12 dos membros superiores, envolvendo 74 pacientes:
- Muito Comuns: desconforto no local da injeção27.
- Comuns: gripe180, pneumonia101, inabilidade, hipocinesia, fraqueza muscular, espasmos181 musculares, dedo em gatilho, polaciúria, vômitos182, deslocamento articular, quedas, contusão183, ardor170 no local da injeção27, dor no local da injeção27.
Espasticidade12 dos membros inferiores: os dados de segurança obtidos de dois estudos clínicos randomizados, controlados com placebo24, duplo-mascarados, e um estudo de extensão aberto, envolvendo aproximadamente 304 pacientes tratados com BOTOX® mostraram o relato das seguintes reações adversas:
- Muito Comuns: infecção64 viral, infecção64 no ouvido.
- Comuns: sonolência, distúrbio da marcha, parestesia77, erupção174 cutânea175, mialgia184, fraqueza muscular, dor nas extremidades, incontinência19 urinaria, quedas, mal estar geral, dor no local da injeção27 e astenia143.
Espasticidade12 focal associada com acidente vascular cerebral150
Os dados de segurança obtidos de estudos clínicos duplo-mascarados e abertos, envolvendo 339 pacientes tratados com BOTOX® mostraram o relato das seguintes reações adversas:
- Comuns: hipertonia177, equimose148, dor na extremidade, fraqueza muscular, dor no local da injeção27, febre179, síndrome93 gripal.
- Incomuns: hipoestesia78, cefaleia48, parestesia77, hipotensão83 ortostática, náusea178, dermatite185, prurido186, erupção174 cutânea175, artralgia187, bursite188, astenia143, dor, hipersensibilidade no local da injeção27, mal estar geral.
Hiperidrose13
Os dados de segurança obtidos de estudos clínicos duplo-mascarados e abertos, envolvendo 397 pacientes tratados com BOTOX® mostraram o relato das seguintes reações adversas:
- Muito Comuns: dor no local da injeção27.
- Comuns: cefaleia48, parestesia77, ondas de calor, náusea178, hiperidrose13, odor anormal na pele139, prurido186, nódulo189 subcutâneo190, alopecia191, dor na extremidade, dor, edema80 no local da injeção27, hemorragia167 no local da injeção27, hipersensibilidade no local da injeção27, irritação no local da injeção27, astenia143.
Em um estudo clínico aberto de BOTOX® (50U por axila) em pacientes adolescentes de 12 a 17 anos de idade (N=144), o evento adverso comum relatado em >3% incluiu tonsillitis (3.5%), nasofaringite (4.9%) e infecção64 do trato respiratório superior (21.5%). Reações adversas reportadas em dois pacientes incluiu dor no local da injeção27 e hiperidrose13. O perfil de segurança de BOTOX® para o tratamento de hiperidrose13 em adolescentes foi similar ao observado em pacientes adultos.
Nota: foi relatado aumento na sudorese146 não axilar em 4,5% dos pacientes dentro de um mês após a injeção27, sem um padrão com relação aos locais anatômicos afetados. Houve desaparecimento em aproximadamente 30% dos pacientes dentro de quatro meses.
Bexiga17 hiperativa
As reações abaixo foram reportadas em estudos duplo-cegos, placebo24 controlados, com BOTOX® 200U durante o ciclo completo de tratamento (duração média de 44 semanas de exposição),
- Muito Comuns: infecção64 no trato urinário65, disúria192.
- Comuns: bacteriuria193, retenção urinária117, volume de urina116 residual*, polaciúria.
*Elevado volume residual115 pós-miccional, sem necessidade de cateterismo113 vesical114.
Reações adversas relacionadas que ocorreram com relativa frequência foram disúria192 e hematúria194. Cateterismo113 vesical114 intermitente195 foi iniciado em 6,5% dos pacientes após tratamento com BOTOX® 100 unidades versus 0,4% do grupo placebo24.
Não houve mudança no perfil geral de segurança com aplicações repetitivas.
Incontinência Urinária15 devido a hiperatividade neurogênica do detrusor da bexiga17
BOTOX® mostrou relato das seguintes reações adversas em estudos duplo-cegos com completo ciclo de tratamento (duração média de 44 semanas de exposição):
- Muito Comuns: infecção64 do trato urinário65, retenção urinária117.
- Comuns: insônia, constipação100, fraqueza muscular, espasmo11 muscular, hematúria194*, disúria192*, divertículo196 da bexiga17, fadiga197, distúrbios da marcha, disreflexia autonômica118*, queda.
*reações adversas relacionadas ao procedimento.
Linhas faciais hipercinéticas
Linhas glabelares: Os dados de segurança obtidos de estudos clínicos multicêntricos, duplo-mascarados, controlados com placebo24, envolvendo 405 pacientes tratados com BOTOX®, mostraram o relato das seguintes reações adversas
- Comuns: cefaleia48, parestesia77, ptose96 palpebral, náusea178, eritema81, tensão na pele139, fraqueza muscular, dor facial, edema80 no local da injeção27, equimose148, dor no local da injeção27, irritação no local da injeção27.
Linhas frontais: Os dados de segurança obtidos de estudos clínicos mostraram as seguintes reações adversas
- Muito Comuns: cefaleia48, edema80 palpebral, ardor170 no local da injeção27, prurido186 no local da injeção27 e dor facial.
Rugas periorbitais: Os dados de segurança obtidos de estudos clínicos mostraram as seguintes reações adversas
- Muito Comuns: ardor170 no local da injeção27.
- Comuns: cefaleia48, ptose96 palpebral, dor facial.
- Rara: diplopia97, fraqueza muscular.
Migrânea21 Crônica
Os dados de segurança obtidos de estudos clínicos duplo-mascarados controlados com placebo24, envolvendo 687 pacientes tratados com BOTOX® mostraram o relato das seguintes reações adversas:
- Comuns: cefaleia48, migrânea21, paresia198 facial, ptose96 palpebral, dor no local da injeção27, prurido186, erupção174 cutânea175, dor na nuca, rigidez musculoesquelética, fraqueza muscular, mialgia184, dor musculoesquelética, espasmo11 muscular, tensão muscular.
- Incomum: disfagia72, dor na pele139, dor no maxilar.
A migrânea21, incluindo o agravamento da enxaqueca49, foi relatada em 3,8% dos pacientes tratados com BOTOX® e 2,6% dos pacientes com placebo24, ocorrendo tipicamente no primeiro mês após o tratamento. Estas reacções não se repetiram consistentemente com os ciclos de tratamento subsequentes e a incidência166 global diminuiu com tratamentos repetidos.
A taxa de interrupção devido a eventos adversos nestes ensaios de fase 3 foi de 3,8% para o BOTOX® vs. 1,2% para o placebo24.
Experiência pós-comercialização
Houve raros relatos espontâneos de óbito199, algumas vezes associado com disfagia72, pneumonia101 e/ou outra debilidade significativa, após o tratamento com a toxina1 botulínica. Também foram relatadas reações graves e/ou reação de hipersensibilidade imediata tal como anafilaxia86 e doença do soro87, assim como outras manifestações de hipersensibilidade incluindo urticária88, edema80 de tecidos moles e dispneia89. Algumas dessas reações foram relatadas após o uso de BOTOX®, tanto isoladamente quanto juntamente com outros produtos associados com reações semelhantes. Foi relatado um caso de anafilaxia86 fatal no qual o paciente foi a óbito199 após ter recebido uma injeção27 de BOTOX® diluído com 5ml de lidocaína a 1%. A relação causal do BOTOX®, da lidocaína ou de ambos não pode ser determinada de modo confiável. Houve também relatos de eventos adversos raros envolvendo o sistema cardiovascular103, incluindo arritmia104 e infarto do miocárdio105, alguns com evolução fatal após o tratamento com BOTOX®. Alguns desses pacientes apresentavam fatores de risco cardiovascular incluindo doença cardiovascular. Foram também relatados: início de convulsões ou convulsões recorrentes após o tratamento com BOTOX®, geralmente em pacientes predispostos. Foi relatado muito raramente, glaucoma112 de ângulo fechado após o tratamento de blefarospasmo com BOTOX®. Foi reportado também lagoftalmos após o uso de BOTOX® nas linhas glabelares.
Os seguintes eventos adversos foram relatados desde que a droga foi comercializada: denervação53/atrofia54 muscular, depressão respiratória/ insuficiência respiratória200, dispneia89, pneumonia101 aspirativa, disartria201, boca149 seca, estrabismo8, neuropatia periférica202, dor abdominal, diarreia203, náuseas204, vômitos182, febre179, anorexia205, borramento de visão98, distúrbio visual, hipoacusia206, zumbido, vertigem207, paralisia35 facial, paresia198 facial, plexopatia braquial, radiculopatia, síncope85, hipoestesia78, mal estar geral, mialgia184, miastenia92 gravis, parestesia77, erupção174 cutânea175, eritema multiforme208, prurido186, dermatite185 psoriásica, hiperidrose13, alopecia191 incluindo madarose, boca149 seca e espasmos181 musculares localizados/contrações musculares involuntárias.
Atenção: este produto é um medicamento que possui nova indicação terapêutica209 no país (Tratamento da bexiga17 hiperativa com sintomas18 de incontinência19, urgência20 e aumento da frequência urinária em pacientes adultos que obtiveram resposta inadequada ou intolerantes à anticolinérgicos) e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, notifique os eventos adversos pelo Sistema de Notificações em Vigilância Sanitária - NOTIVISA ou à Vigilância Sanitária Estadual ou Municipal."
SUPERDOSE
Superdosagem para BOTOX® é um termo relativo e depende da dose total injetada, local de injeção27 e propriedades dos tecidos subjacentes aos injetados. Os sinais59 e sintomas18 de superdosagem podem não ser percebidos imediatamente após a injeção27. Doses excessivas podem produzir paralisia35 neuromuscular local, ou à distância, generalizada e profunda. Se injeção27 acidental, ingestão oral ou superdosagem forem consideradas, o paciente deve ser clinicamente monitorado por até várias semanas visando detectar a evolução de sinais59 e sintomas18 de fraqueza muscular , os quais podem ser locais ou distantes do local de aplicação e podem incluir ptose96, diplopia97, disfagia72, disartria201, fraqueza generalizada ou falência respiratória. Estes pacientes devem ser considerados para avaliação médica adicional e a terapia médica apropriada imediatamente instituída, a qual pode incluir hospitalização.
Se a musculatura da orofaringe210 e esôfago70 for afetada, pode ocorrer aspiração levando à pneumonia101 aspirativa. Se os músculos respiratórios211 tornaram-se paralisados ou suficientemente enfraquecidos, entubação e respiração assistida podem ser necessárias até total recuperação do quadro. Cuidados de apoio podem envolver a necessidade de traqueostomia212 e/ou ventilação213 mecânica prolongada, além de outros cuidados gerais de suporte.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
Reg. ANVISA/MS - 1.0147.0045
Farm. Resp.: Elizabeth Mesquita CRF-SP nº 14.337
Fabricado por:
Allergan Pharmaceuticals Ireland Westport - Irlanda
Importado e Distribuído por:
Allergan Produtos Farmacêuticos Ltda.
Guarulhos, São Paulo
Registrado por:
Allergan Produtos Farmacêuticos Ltda.
Av. Eng. Luís Carlos Berrini, 105 Torre 3 - 18º andar - Cidade Monções
São Paulo - CEP 04571-900
CNPJ: 43.426.626/0001-7
SAC 0800 17 4077