Tilestal (Bula do profissional de saúde)
ATIVUS FARMACÊUTICA LTDA
IDENTIFICAÇÃO DO MEDICAMENTO
Tilestal
cloridrato de tramadol + paracetamol
Comprimidos
MEDICAMENTO SIMILAR EQUIVALENTE AO MEDICAMENTO DE REFERÊNCIA
APRESENTAÇÕES
Comprimido revestido
Caixa com 10 e 20 comprimidos
USO ORAL
USO ADULTO
COMPOSIÇÃO
Cada comprimido revestido contém:
| cloridrato de tramadol | 37,5 mg |
| paracetamol | 325 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: copovidona, amido, estearato de magnésio, álcool polivinílico, macrogol, talco, dióxido de titânio, corante óxido de ferro amarelo, ácido esteárico, crospovidona e povidona.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE1
INDICAÇÕES
Tilestal é indicado para dores moderadas a severas de caráter agudo2, subagudo3 e crônico4.
RESULTADOS DE EFICÁCIA
Estudos de dose única
Em estudos duplo-cegos controlados por placebo5 e ativo, de grupos paralelos, de dose única e com desenho fatorial, dois comprimidos de cloridrato de tramadol + paracetamol administrados em pacientes com dor após procedimentos cirúrgicos orais proporcionaram melhor alívio do que o placebo5 ou até mesmo que uma mesma dose dos componentes ativos isolados. O início do alívio da dor após a administração de cloridrato de tramadol + paracetamol foi mais rápido que o tramadol isolado. O início da analgesia ocorreu em menos de uma hora. A duração do alívio da dor após administração de cloridrato de tramadol + paracetamol foi maior que a do paracetamol isolado. A analgesia foi, em geral, comparável ao ibuprofeno, o comparador. Em outro estudo de dose única em indivíduos com dor houve uma dose-resposta estatisticamente significativa para o alívio da dor proveniente de procedimentos cirúrgicos orais em relação ao placebo5; 37,5 mg de cloridrato de tramadol/325 mg de paracetamol; e 75 mg de cloridrato de tramadol/650 mg de paracetamol.
Estudos para o tratamento de dor aguda
O estudo CAPSS-105 avaliou a segurança e eficácia de cloridrato de tramadol + paracetamol no tratamento de crises dolorosas de osteoartrite6 no joelho e quadril. Todos os 308 indivíduos randomizados foram incluídos na população a ser tratada (intenção de tratamento) e na população a ser avaliada quanto à segurança. Desses indivíduos, 197 foram randomizados com cloridrato de tramadol/paracetamol (102 com 37,5 mg de cloridrato de tramadol/325 mg de paracetamol; 95 com 75 mg de cloridrato de tramadol/ 650 mg de paracetamol para a dose inicial) e 111 foram randomizados com placebo5. Os grupos de tratamento foram semelhantes em relação às características demográficas, como sexo e idade. A maioria dos indivíduos teve o joelho designado como articulação7 alvo do estudo (77,9%). Após uma dose inicial, os indivíduos receberam 1 a 2 comprimidos de 37,5 mg de cloridrato de tramadol/325 mg de paracetamol ou placebo5 correspondente a cada 4 a 6 horas, conforme necessário. Em geral, o cloridrato de tramadol/paracetamol foi mais efetivo que o placebo5 em ajudar os indivíduos em gerenciar as crises dolorosas de osteoartrite6. Durante os Dias 1 ao 5, o cloridrato de tramadol/paracetamol foi significativamente mais efetivo que o placebo5 em diminuir a média diária do Escore de Intensidade da Dor (p<0,001) e em aumentar a média diária do Escore para Alívio da Dor (p<0,001).
O estudo CAPSS-115 comparou o cloridrato de tramadol/paracetamol e paracetamol/codeína em indivíduos com dor pós-cirúrgica (ortopédica ou abdominal). De 306 indivíduos randomizados, 98 foram randomizados com cloridrato de tramadol/paracetamol, 99 com placebo5 e 109 com paracetamol com fosfato de codeína (30 mg). Não houve diferenças clinicamente significativas entre os três grupos de tratamento para qualquer característica demográfica ou de linha de base. O cloridrato de tramadol/paracetamol foi estatisticamente superior ao placebo5 para todas as três variáveis primárias, ou seja, TOTPAR (alívio total da dor) (p=0,004), SPID (soma da diferença da intensidade da dor) (p=0,015) e SPRID (soma do total de alívio da dor e soma das diferenças da intensidade da dor) (p=0,005).
Estudos de tratamento de dor crônica
Os comprimidos de cloridrato de tramadol + paracetamol (37,5 mg de cloridrato de tramadol + 325 mg de paracetamol) foram avaliados em três estudos controlados por placebo5, em 960 pacientes com osteoartrite6 do quadril e joelho, e dor lombar.
Cada estudo controlado por placebo5 iniciou com um período de titulação de dose de aproximadamente 10 dias, seguidos por uma fase de manutenção com doses de 1 a 2 comprimidos (37,5 mg de tramadol/325 mg de paracetamol para 75 mg de tramadol/650 mg de paracetamol) a cada 4 a 6 horas, não excedendo o máximo de 8 comprimidos ao dia. Todos os três estudos tiveram uma duração de tratamento de 90 dias. A dose diária média de cloridrato de tramadol + paracetamol para os estudos controlados variou de 4,1 para 4,2 comprimidos.
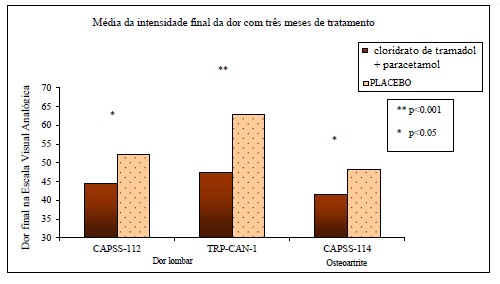
Dores de osteoartrite6 (CAPSS-114) e dor lombar (TRP-CAN-1 e CAPSS-112)
Todos os três estudos tiveram a intensidade final da dor medida pela Escala Visual Analógica da Dor (100 mm) (VAS) como desfecho primário (veja Tabela 1 a seguir).
CAPSS-114: O estudo CAPSS-114 incluiu 306 indivíduos que tiveram osteoartrite6 sintomática8 durante pelo menos 1 ano e continuaram a ter ao menos dor moderada devido à osteoartrite6 (≥ 50/100 mm na VAS) apesar do tratamento com doses estabelecidas de celecoxibe (≥ 200 mg/dia) ou rofecoxibe (25 mg/dia) por pelo menos 2 semanas. Nenhuma outra medicação para dor ou outro tratamento que não fosse o medicamento estudado e os inibidores seletivos da COX-2 foram permitidos durante o andamento do estudo. Os indivíduos tratados com cloridrato de tramadol + paracetamol receberam uma média de 155 mg de tramadol/1346 mg de paracetamol durante o período de estudo.
CAPSS-112 e TRP-CAN-1: Nos estudos CAPSS-112 e TRP-CAN-1 foram incluídos 654 pacientes com dor lombar crônica que foi suficientemente grave para requerer medicação diariamente nos três meses anteriores e ao menos dor moderada (40/100 mm) na VAS. A média diária de doses de cloridrato de tramadol + paracetamol para CAPSS-112 e TRP-CAN-1 foi 159 mg de tramadol/1391 mg de paracetamol e 158 mg de tramadol/1369 mg de paracetamol, respectivamente.
Tabela 1: Intensidade final da dor medida pela Escala Visual Analógica (100 mm), estudos de longa duração de dor de osteoartrite6 (CAPSS-114), dor lombar (TRP-CAN-1 e CAPSS-112)
|
N° do estudo |
Idade média em anos (Faixa) |
Desfecho primário |
Teste |
Comparador |
|
cloridrato de tramadol + paracetamol |
Placebo5 |
|||
|
PRI/TRP-CAN-1 |
55,7 (22-76) |
Intensidade Final da Dor (100 mm VAS) |
|
|
|
Linha de base |
67,9 ± 14,95 |
67,6 ± 15,53 |
||
|
Final |
47,4 ± 31,39 |
62,9 ± 27,50 |
||
|
|
cloridrato de tramadol + paracetamol vs. Placebo5, p<0,001 |
|||
|
CAPSS-112 |
57,5 (25-82) |
Intensidade Final da Dor (100 mm VAS) |
|
|
|
Linha de base |
71,1 ± 14,54 |
68,8 ± 14,87 |
||
|
Final |
44,4 ± 30,59 |
52,3 ± 29,11 |
||
|
|
cloridrato de tramadol + paracetamol vs. Placebo5, p=0,015 |
|||
|
CAPSS-114 |
49,6 (19-75) |
Intensidade Final da Dor (100 mm VAS) |
|
|
|
Linha de base |
69,0 ± 12,52 |
69,5 ± 13,17 |
||
|
Final |
41,5 ± 26,0 |
48,3 ± 26,63 |
||
|
|
cloridrato de tramadol + paracetamol vs. Placebo5, p=0,025 |
|||
A média dos Escores de Intensidade Final da Dor com três meses de tratamento estão apresentadas na Figura 1 a seguir.
Figura 1: Média da intensidade final da dor com três meses de tratamento vs. Dor final na Escala Visual Analógica.
Referências:
- Medve RA, Wang J, Karim R. Tramadol and acetaminophen tablets for dental pain. Anesth Prog. 2001;48(3):79-81.
- Fricke JR Jr, Karim R, Jordan D, Rosenthal N. A double-blind, single-dose comparison of the analgesic efficacy of tramadol/acetaminophen combination tablets, hydrocodone/acetaminophen combination tablets, and placebo5 after oral surgery. Clin Ther. 2002;24(6):953-968.
- Silverfield JC, Kamin M, Wu S-C, Rosenthal N. Tramadol/acetaminophen combination tablets for the treatment of osteoarthritis flare pain: a multicenter, outpatient, randomized, double-blind, placebo5-controlled, parallel-group, add-on study. Clin Ther. 2002;24(2):282-297.
- Rosenthal NR, Silverfield JC, Wu SC, Jordan D, Kamin M. Tramadol/acetaminophen combination tablets for the treatment of pain associated with osteoarthritis flare in an elderly patient population. J Am Geriatr Soc 2004, 52:374-380.
- Smith AB, Ravikumar TS, Kamin M, Jordan D, Xiang J, Rosenthal N et al. Combination tramadol plus acetaminophen for postsurgical pain. The American Journal of Surgery. 2004; 187:521-527.
- Bourne, MH, Rosenthal NR, Xiang J, Jordan D, Kamin M. Tramadol/acetaminophen (ULTRACET®) tablets in the treatment of postsurgical orthopedic pain. Am J Orthoped. Dec 2005; 34(12):592-597.
- Emkey R, Rosenthal N, Wu SC, Jordan D, Kamin M, for the CAPSS-114 Study Group. Efficacy and safety of tramadol/acetaminophen tablets (ULTRACET®) as add-on therapy for osteoarthritis pain in subjects receiving a COX-2 nonsteroidal antiinflammatory drug: a multicenter, randomized, double-blind, placebo5-controlled trial. Journal of Rheumatology. 2004; 31(1): 150- 156.
- Ruoff GE, Rosenthal N, Jordan D, Karim R, Kamin M. Tramadol/Acetaminophen combination tablets for the treatment of chronic lower back pain. Clin. Ther. 2003; 25(4): 1123-1141.
- Peloso PM, Fortin L, Beaulieu A, Kamin M, Rosenthal N, on behalf of the Protocol TRP-CAN-1 Study Group. Analgesic efficacy and safety of tramadol/acetaminophen combination tablets (ULTRACET®) in treatment of chronic low back pain: a multicenter, outpatient, randomized, double blind, placebo5 controlled trial. J Rheumatol. 2004; 31(12):2454-2463.
CARACTERÍSTICAS FARMACOLÓGICAS
Grupo farmacoterapêutico: analgésicos9, opioides em combinação com analgésicos9 não-opioides, código ATC: N02AJ13.
Propriedades Farmacodinâmicas
O tramadol é um analgésico10 sintético de ação central. Embora o seu modo de ação não seja totalmente conhecido, a partir de testes em animais pelo menos dois mecanismos complementares parecem aplicáveis: ligação do fármaco11 e do metabólito12 M1 aos receptores de µ-opioide e inibição fraca da recaptação da norepinefrina e da serotonina.
O paracetamol é outro analgésico10 de ação central. Embora o sítio e os mecanismos de ação exatos não estejam claramente definidos, parece que o paracetamol produz analgesia através da elevação do limiar da dor. O mecanismo potencial pode envolver inibição da via do óxido nítrico mediada por uma variedade de receptores de neurotransmissores incluindo N-metil-D-aspartato e Substância P.
Quando avaliada em modelo animal padrão, a combinação de tramadol e paracetamol exibiu um efeito sinérgico. Isto é, quando tramadol e paracetamol são administrados em conjunto, uma quantidade significativamente menor de cada fármaco11 foi necessária para produzir um determinado efeito analgésico10 que seria esperado se seus efeitos fossem meramente aditivos. O tramadol atinge atividade de pico em 2 a 3 horas com um efeito analgésico10 prolongado, de forma que a sua combinação com paracetamol, um agente analgésico10 de início de ação rápido e de curta duração, fornece benefício substancial aos pacientes em relação aos componentes isolados.
Propriedades Farmacocinéticas
O tramadol é administrado sob a forma de racemato e tanto a forma (-) como a (+) do tramadol e do metabólito12 M1 são detectadas na circulação13. Embora o tramadol seja absorvido rapidamente após a administração, a sua absorção é mais lenta (e a meia-vida mais longa) quando comparado ao paracetamol.
Após dose oral única da combinação de tramadol e paracetamol (37,5 mg/325,0 mg), concentrações plasmáticas de pico de 64,3 ng/mL / 55,5 ng/mL de (+) tramadol/(-) tramadol e 4,2 mcg/mL de paracetamol são alcançadas após 1,8 horas e 0,9 hora respectivamente. As meias-vidas de eliminação (t1/2) são 5,1 h / 4,7 h para (+) tramadol / (-) tramadol e 2,5 horas para o paracetamol.
Estudos farmacocinéticos de dose única e múltipla realizados com cloridrato de tramadol + paracetamol em voluntários não mostraram interações medicamentosas significativas entre tramadol e paracetamol.
Absorção
O cloridrato de tramadol apresenta biodisponibilidade absoluta média de aproximadamente 75% após a administração de uma única dose oral de tramadol comprimido de 100 mg. A concentração plasmática máxima média de tramadol racêmico14 e M1 após administração de dois comprimidos de cloridrato de tramadol + paracetamol ocorre aproximadamente duas e três horas, respectivamente, após a dose em adultos saudáveis.
A absorção oral de paracetamol após a administração de Tilestal é rápida e quase completa e ocorre, principalmente, no intestino delgado15. O pico de concentração plasmática do paracetamol ocorre dentro de 1 hora e não é afetado pela coadministração com tramadol.
Efeito da alimentação
A administração oral de Tilestal com alimentos não afeta de forma significativa a concentração plasmática máxima ou a extensão de absorção de tramadol ou paracetamol, de modo que Tilestal pode ser tomado independentemente das refeições.
Distribuição
Após dose intravenosa de 100 mg, o volume de distribuição de tramadol foi 2,6 e 2,9 L/kg em homens e mulheres, respectivamente.
A ligação de tramadol às proteínas16 plasmáticas é aproximadamente 20% e a ligação parece ser independente da concentração até 10 mcg/mL. A saturação da ligação à proteína plasmática ocorre apenas em concentração fora da faixa clinicamente relevante. O paracetamol parece ser amplamente distribuído para a maioria dos tecidos, exceto para a gordura17. O seu volume de distribuição aparente é 0,9 L/kg. Uma porção relativamente pequena (~20%) do paracetamol liga-se às proteínas16 plasmáticas.
Metabolismo18
Os perfis de concentração plasmática de tramadol e seu metabólito12 M1 medidos após a administração de cloridrato de tramadol + paracetamol em voluntários, não mostraram alteração significativa comparado à administração de tramadol isolado.
Aproximadamente 30% da dose é excretada na urina19 como fármaco11 inalterado, enquanto que 60% da dose é excretada como
metabólitos20. As principais vias metabólicas parecem ser a N- e a O-desmetilação e a glicuronidação ou sulfatação no fígado21. O tramadol é extensivamente metabolizado por diversas vias, incluindo a CYP2D6. Os pacientes que são metabolizadores ultrarrápidos através da CYP2D6 podem converter tramadol no seu metabólito12 ativo (M1) de maneira mais rápida e completa do que outros pacientes. A prevalência22 deste genótipo23 CYP2D6 varia de acordo com a população e tem sido relatada na literatura de 1% a 10% em afro-americanos, americanos caucasianos, asiáticos e europeus (incluindo estudos específicos em gregos, húngaros e europeus do norte) até cifras tão altas quanto 29% em Africanos / etíopes.
Aproximadamente 7% da população tem atividade reduzida da isoenzima CYP2D6 do citocromo P450 e são considerados “metabolizadores pobres” de debrisoquina, dextrometorfano, antidepressivos tricíclicos, entre outros medicamentos. Após uma dose oral única de tramadol, as concentrações de tramadol foram apenas ligeiramente maiores em “metabolizadores pobres” em relação aos “metabolizadores extensivos”, enquanto que as concentrações de M1 foram menores.
O paracetamol é metabolizado principalmente no fígado21 pela cinética24 de primeira ordem e envolve 3 vias principais separadas: a) conjugação com glicuronídeo; b) conjugação com sulfato e c) oxidação via citocromo, P450-dependente, via enzima25 oxidase de função mista para formar um metabólito12 intermediário reativo, o qual se conjuga com glutationa e é metabolizado para formar cisteína e conjugados do ácido mercaptúrico. A principal isoenzima do citocromo P450 envolvida parece ser a CYP2E1, com vias adicionais da CYP1A2 e CYP3A4.
Em adultos, a maior parte do paracetamol é conjugada com ácido glicurônico e, em menor extensão, com sulfato. Estes metabólitos20 derivados de glicuronídeo, sulfato e glutationa não têm atividade biológica. Em bebês26 prematuros, recém-nascidos e crianças pequenas, o conjugado de sulfato predomina.
Excreção
O tramadol e seus metabólitos20 são eliminados principalmente pelo rim27. As meias-vidas de eliminação do tramadol e de M1 são aproximadamente 6 e 7 horas, respectivamente. A meia-vida de eliminação plasmática do tramadol aumentou de aproximadamente 6 para 7 horas com doses múltiplas.
A meia-vida do paracetamol é cerca de 2 a 3 horas em adultos, sendo um pouco mais curta em crianças e um pouco mais longa em recém-nascidos e pacientes cirróticos. O paracetamol é eliminado principalmente pela formação de conjugados de glicuronídeo e sulfato de maneira dose-dependente. Menos de 9% do paracetamol é excretado inalterado na urina19.
CONTRAINDICAÇÕES
Hipersensibilidade ao tramadol, paracetamol ou a qualquer componente da fórmula ou aos opioides; intoxicações agudas pelo álcool, hipnóticos, narcóticos, analgésicos9 de ação central, opioides ou psicotrópicos28; pacientes em tratamento com inibidores da monoaminoxidase29 (MAO30) ou tratados com estes agentes nos últimos 14 dias.
ADVERTÊNCIAS E PRECAUÇÕES
Convulsões
Convulsões foram relatadas em pacientes recebendo tramadol na dose recomendada. Relatos espontâneos pós-comercialização indicam que o risco de convulsões está aumentado com doses de tramadol acima das recomendadas. O uso concomitante de tramadol aumenta o risco de convulsões em pacientes tomando:
- inibidores seletivos da recaptação da serotonina (antidepressivos ou anoréticos);
- antidepressivos tricíclicos e outros compostos tricíclicos (ex.: ciclobenzaprina, prometazina, etc) ou;
- opioides.
A administração de tramadol pode aumentar o risco de convulsão31 em pacientes tomando inibidores da monoaminoxidase29 (MAO30), neurolépticos32 ou outros fármacos que reduzem o limiar convulsivo.
O risco de convulsões também pode estar aumentado em pacientes com epilepsia33, aqueles com história de convulsões ou em pacientes com risco reconhecido para convulsões [tais como trauma craniano, distúrbios metabólicos, abstinência de álcool ou drogas, infecções34 do Sistema Nervoso Central35 (SNC36)]. Na superdose de tramadol, a administração de naloxona pode aumentar o risco de convulsão31.
Reações anafilactoides
Pacientes com história de reações anafilactoides à codeína e a outros opioides podem estar sob risco aumentado e, portanto, não devem ser tratados com Tilestal.
Dependência de drogas e potencial de abuso
Tilestal contém tramadol como princípio ativo. Parte do efeito analgésico10 de Tilestal é atribuível à ligação do princípio ativo, tramadol, ao receptor mu-opioide. Após administrações repetidas de opioides, pode ocorrer o desenvolvimento de tolerância, dependência física e dependência psicológica, mesmo nas doses recomendadas. Avaliar o risco de cada paciente para dependência e abuso de opioides antes de prescrever Tilestal e monitorar todos os pacientes que recebem Tilestal em relação ao desenvolvimento destes comportamentos. Os riscos são maiores em pacientes com história pessoal ou familiar de abuso de substâncias (incluindo abuso ou dependência de drogas ou álcool) ou doença mental (por exemplo, depressão maior).
Tilestal não deve ser administrado a pacientes dependentes de opioides. O tramadol reinicia a dependência física em alguns pacientes previamente dependentes de outros opioides.
Uso com depressores do Sistema Nervoso Central35 (SNC36), incluindo álcool
O uso concomitante de tramadol (princípio ativo de Tilestal) com depressores do SNC36, incluindo o álcool, pode causar efeitos aditivos aos depressores do SNC36, incluindo sedação37 profunda e depressão respiratória. Tilestal deve ser usado com cautela e em dose reduzida em pacientes recebendo depressores do SNC36, ambos pelo menor tempo possível (vide “Interações medicamentosas”).
Risco aumentado de hepatotoxicidade38 com o uso de álcool
Alcoólatras crônicos podem estar sob risco aumentado de toxicidade39 hepática40 com o uso excessivo de paracetamol.
Uso com inibidores seletivos da recaptação da serotonina
Tilestal deve ser usado com bastante cautela em pacientes sob tratamento com inibidores seletivos da recaptação da serotonina (ISRSs). O uso concomitante de tramadol com inibidores seletivos da recaptação da serotonina (ISRSs) aumenta o risco de eventos adversos, incluindo convulsões e síndrome serotoninérgica41.
Depressão respiratória
Pacientes com depressão respiratória significativa ou asma42 brônquica grave ou aguda apresentam um risco aumentado de depressão respiratória com risco de vida, quando tratados com opioides. Tilestal só deve ser utilizado nesta população de pacientes em um ambiente monitorado e com disponibilidade de equipamento de ressuscitação.
Tilestal deve ser administrado com cautela em pacientes sob risco de depressão respiratória. Quando grandes doses de tramadol são administradas com medicamentos anestésicos ou álcool, pode ocorrer depressão respiratória e tais casos devem ser tratados como superdose. Se a naloxona for administrada, deve-se ter cautela, pois ela pode precipitar a ocorrência de convulsões.
Metabolismo18 ultrarrápido do tramadol pela CYP2D6
Os pacientes que são metabolizadores ultrarrápidos através da CYP2D6, podem converter o tramadol para o seu metabólito12 ativo (M1) de maneira mais rápida e completa do que outros pacientes. Esta rápida conversão pode resultar em níveis maiores que os esperados de M1 no soro43, o que poderia levar a um aumento do risco de depressão respiratória (vide “Superdose – Sintomas44 e sinais45 - o tramadol”). Medicação alternativa, a redução da dose e/ou monitorização frequente dos sinais45 de superdose por tramadol, tais como depressão respiratória, é recomendada em pacientes sabidamente metabolizadores ultrarrápidos por CYP2D6 (vide “Propriedades farmacocinéticas”).
Aumento da pressão intracraniana ou traumatismo46 craniano
Tilestal deve ser usado com cautela em pacientes com pressão intracraniana aumentada ou traumatismo46 craniano.
Alterações da pupila (miose47) provocadas pelo tramadol podem mascarar a existência, extensão ou curso da patologia48 intracraniana. Um alto índice de suspeita de reação adversa deve ser observado ao avaliar o estado mental alterado destes pacientes se estiverem recebendo Tilestal.
A administração de Tilestal pode complicar a avaliação clínica de pacientes com condições abdominais agudas.
Tratamento da abstinência
Sintomas44 de abstinência como ansiedade, sudorese49, insônia, rigidez, dor, náusea50, tremores, diarreia51, sintomas44 do trato respiratório superior e piloereção52 podem ocorrer se Tilestal for descontinuado de forma abrupta. Ataque de pânico, ansiedade grave, alucinação53, parestesia54, tinido e sintomas44 do SNC36 não usuais foram também raramente relatados com a descontinuação abrupta do cloridrato de tramadol. A experiência clínica sugere que os sintomas44 de abstinência podem ser aliviados pela redução gradual da medicação.
Disfunção renal55
O cloridrato de tramadol + paracetamol não foi estudado em pacientes com disfunção renal55. A experiência com tramadol sugere que a disfunção renal55 resulta em decréscimo da taxa e da extensão de excreção do tramadol e seu metabólito12 ativo, M1. Em pacientes com depuração de creatinina56 menor que 30 mL/min, recomenda-se que o intervalo de administração de Tilestal seja aumentado, não excedendo 2 comprimidos a cada 12 horas.
Disfunção hepática40
O cloridrato de tramadol + paracetamol não foi estudado em pacientes com disfunção hepática40 e o seu uso não é recomendado em pacientes com disfunção hepática40 grave.
Reações cutâneas57 graves
Reações cutâneas57 graves, tais como pustulose exantematosa aguda generalizada, síndrome de Stevens-Johnson58, e necrólise epidérmica tóxica59, foram relatadas muito raramente em pacientes recebendo paracetamol. Os pacientes devem ser informados sobre os sinais45 de reações cutâneas57 graves e o uso do medicamento deve ser descontinuado no primeiro aparecimento de erupção60 cutânea61 ou de qualquer outro sinal62 de hipersensibilidade.
Hiponatremia63
A hiponatremia63 foi relatada muito raramente com o uso de cloridrato de tramadol + paracetamol, geralmente em pacientes com fatores de risco predisponentes, como pacientes idosos e / ou em pacientes em uso de medicações concomitantes que podem causar hiponatremia63. Em alguns relatórios, a hiponatremia63 pareceu ser o resultado da síndrome64 de secreção inapropriada de hormônio65 antidiurético (SIADH) e resolvida com a descontinuação de Tilestal e do tratamento apropriado (por exemplo, restrição de fluidos). Durante o tratamento com Tilestal, monitorização de sinais45 e sintomas44 da hiponatremia63 é recomendado para pacientes66 com fatores de risco predisponentes.
Uso em crianças
A segurança e a eficácia de cloridrato de tramadol + paracetamol não foram estudadas na população pediátrica.
Precauções gerais
A dose recomendada de Tilestal não deve ser excedida.
Tilestal não deve ser coadministrado com outros produtos à base de tramadol ou paracetamol.
Gravidez67, Lactação68 e Fertilidade
Categoria C – Não há estudos adequados em mulheres. Em experiências animais ocorreram alguns efeitos colaterais69 no feto70, mas o benefício do produto pode justificar o risco potencial durante a gravidez67.
Foi demonstrado que tramadol atravessa a placenta.
Não existem estudos adequados e bem controlados em mulheres grávidas. Não foi estabelecida a utilização segura durante a gravidez67.
O uso prolongado de Tilestal ou outros opioides durante a gravidez67, pode levar à síndrome64 de abstinência neonatal. Este risco é
particularmente aumentado durante o último trimestre da gravidez67.
O cloridrato de tramadol + paracetamol não é recomendado para mães que estejam amamentando, pois a segurança em crianças e recém-nascidos não foi estudada.
Não foi avaliado o efeito de tramadol ou a combinação tramadol/paracetamol na fertilidade humana.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista. Efeitos sobre a capacidade de dirigir e operar máquinas.
Tilestal pode afetar a habilidade mental ou física necessária para a realização de tarefas potencialmente perigosas como dirigir ou operar máquinas.
Durante o tratamento, o paciente não deve dirigir veículos ou operar máquinas, pois sua habilidade e atenção podem estar prejudicadas.
Não use outro produto que contenha paracetamol.
INTERAÇÕES MEDICAMENTOSAS
Uso com inibidores da MAO30
O uso concomitante de Tilestal com inibidores da MAO30, ou dentro de 14 dias após sua descontinuação, é contraindicado devido ao risco aumentado de convulsões e síndrome serotoninérgica41 (vide “Contraindicações”).
Uso com inibidores seletivos da recaptação da serotonina
O uso concomitante de tramadol com ISRSs aumenta o risco de eventos adversos, incluindo convulsões e síndrome serotoninérgica41. Deve-se ter cautela quando administrar Tilestal a pacientes utilizando ISRSs e monitorar os sinais45 de eventos adversos.
Depressores do Sistema Nervoso Central35 (SNC36), incluindo álcool
O uso concomitante de tramadol com depressores do sistema nervoso central35, como benzodiazepinas e outros sedativos/hipnóticos, agentes anestésicos, fenotiazinas, tranquilizantes, opioides ou álcool, pode produzir efeitos depressivos aditivos no SNC36, tais como sedação37 profunda e depressão respiratória. Se o uso concomitante de Tilestal com um depressor do SNC36 for clinicamente necessário, prescrever as menores doses eficazes com duração mínima para ambos os medicamentos, e acompanhar rigorosamente os pacientes quanto a sinais45 de depressão respiratória.
Uso com carbamazepina
A administração concomitante de Tilestal e carbamazepina causa um aumento significativo no metabolismo18 de tramadol.
Pacientes tomando carbamazepina podem ter redução significativa do efeito analgésico10 do tramadol.
Uso com quinidina
O tramadol é metabolizado para M1 pela isoenzima CYP2D6. A administração concomitante de quinidina e tramadol resulta em concentrações aumentadas de tramadol e reduzidas de M1. As consequências clínicas destes achados são desconhecidas. Estudos de interação medicamentosa “in vitro” em microssomas hepáticos humanos indicam que o tramadol não tem efeito sobre o metabolismo18 da quinidina.
De acordo com os relatórios de farmacovigilância, os relatos de toxicidade39 da digoxina são raros.
Uso com compostos do tipo varfarina
Existem vários relatos que sugerem que o paracetamol pode produzir hipoprotrombinemia discreta quando administrado com compostos semelhantes à varfarina. Os dados de farmacovigilância revelaram alterações raras do efeito da varfarina, incluindo elevação dos tempos de protrombina71. Embora tais alterações tenham significância clínica limitada, a avaliação periódica do tempo de protrombina71 deve ser realizada quando cloridrato de tramadol + paracetamol e estes agentes são administrados concomitantemente, devido aos relatos de aumento de RNI (Relação Normalizada Internacional) em alguns pacientes.
Uso com anticonvulsivantes
Alguns relatos sugerem que os pacientes tomando anticonvulsivantes a longo prazo que excedem a dose de paracetamol podem estar sob risco aumentado de hepatotoxicidade38 devido ao metabolismo18 acelerado do paracetamol.
Uso com diflunisal e paracetamol
A administração concomitante de diflunisal e paracetamol produz aumento de 50% nos níveis plasmáticos de paracetamol em voluntários normais. Tilestal deve ser usado com cautela e os pacientes monitorados cuidadosamente.
Uso com inibidores da CYP2D6
Os estudos de interação medicamentosa in vitro em microssomas hepáticos humanos indicam que a administração concomitante de cloridrato de tramadol + paracetamol com inibidores da CYP2D6, como fluoxetina, paroxetina e amitriptilina pode resultar em alguma inibição do metabolismo18 do tramadol.
Uso com cimetidina
A administração concomitante de cloridrato de tramadol + paracetamol e cimetidina não foi estudada. A administração de tramadol e cimetidina não resulta em alterações clinicamente significativas na farmacocinética do tramadol.
Interação com alimentos
A administração de Tilestal com alimentos não afeta de forma significativa a sua taxa ou extensão de absorção.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Conservar em temperatura ambiente (entre 15 e 30°C). Proteger da luz e umidade.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas
Comprimido revestido oblongo de cor amarela.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Administração
Os comprimidos de Tilestal devem ser administrados por via oral.
Tilestal pode ser administrado independentemente das refeições.
Posologia
A dose diária máxima de Tilestal é 1 a 2 comprimidos a cada 4 a 6 horas, de acordo com a necessidade para alívio da dor, até o máximo de 8 comprimidos ao dia.
Nas condições dolorosas crônicas, o tratamento deve ser iniciado com 1 comprimido ao dia e aumentado em 1 comprimido a cada 3 dias, conforme a tolerância do paciente, até atingir a dose de 4 comprimidos ao dia. Depois disso, Tilestal pode ser administrado na dose de 1-2 comprimidos a cada 4-6 horas, até o máximo de 8 comprimidos ao dia.
Nas condições dolorosas agudas, o tratamento pode ser iniciado com a dose terapêutica72 completa (1-2 comprimidos a cada 4-6 horas), até o máximo de 8 comprimidos ao dia.
Tratamento de Abstinência
Os sintomas44 de abstinência podem ser aliviados pela redução gradual da medicação (vide “Advertências e precauções – Tratamento de abstinência”).
Populações especiais
Disfunção renal55: Em pacientes com depuração de creatinina56 inferior a 30 mL/min, recomenda-se aumentar o intervalo entre as administrações de Tilestal de forma a não exceder 2 comprimidos a cada 12 horas.
Insuficiência hepática73: Não é recomendado o uso de Tilestal em pacientes com insuficiência hepática73 grave.
Idosos (65 anos ou mais): Não foram observadas diferenças gerais em relação à segurança ou à farmacocinética entre indivíduos ≥ 65 anos de idade e indivíduos mais jovens.
Este medicamento não deve ser partido, aberto ou mastigado.
REAÇÕES ADVERSAS
Reações adversas ao medicamento em estudos clínicos
Como os estudos clínicos são conduzidos sob condições muito específicas, as taxas dos eventos adversos em estudos clínicos podem não refletir as taxas observadas na prática e não devem ser comparados com taxas de estudos clínicos de outros fármacos. As informações provenientes de estudos clínicos são úteis para identificar os eventos adversos relacionados ao medicamento e para aproximação das taxas.
O cloridrato de tramadol + paracetamol foi administrado a 1597 pacientes durante estudos duplo-cegos ou abertos em períodos longos para dor crônica não oncológica. Destes pacientes, 539 tinham 65 anos de idade ou mais. Os eventos adversos relatados com maior frequência foram no sistema nervoso central35 e gastrintestinal. Estes são efeitos comuns associados a outros fármacos com atividade agonista74 opioide.
Tabela 2. Eventos adversos relatados em pelo menos 2% dos indivíduos que receberam cloridrato de tramadol + paracetamol para dor crônicaª e com incidência75 maior que o placebo5.
|
Sistema corpóreo |
cloridrato de tramadol + paracetamol (N=481) |
Placebo5 (N=479) |
|
|
Eventos Adversos |
|
|
|
|
Corpo como um todo |
|||
|
Fadiga76 |
7 |
2 |
|
|
Ondas de calor |
2 |
0 |
|
|
Sintomas44 gripais |
3 |
2 |
|
|
Distúrbios cardiovasculares |
|||
|
Hipertensão77 |
3 |
1 |
|
|
Distúrbios do sistema nervoso central35 e periférico |
|||
|
Dor de cabeça78 |
15 |
10 |
|
|
Tontura79 |
11 |
4 |
|
|
Hipoestesia80 |
2 |
0 |
|
|
Distúrbios do sistema gastrintestinal |
|||
|
Náusea50 |
18 |
5 |
|
|
Constipação81 |
16 |
5 |
|
|
Boca82 seca |
8 |
1 |
|
|
Vômito83 |
5 |
1 |
|
|
Dor abdominal |
5 |
4 |
|
|
Diarreia51 |
5 |
3 |
|
|
Distúrbios psiquiátricos |
|||
|
Sonolência |
14 |
2 |
|
|
Insônia |
5 |
1 |
|
|
Anorexia84 |
4 |
1 |
|
|
Nervosismo |
2 |
0 |
|
|
Distúrbios da pele85 e anexos86 |
|||
|
Prurido87 |
6 |
1 |
|
|
Sudorese49 aumentada |
4 |
0 |
|
|
Erupção60 cutânea61 |
3 |
1 |
|
ªem estudos controlados com placebo5 com duração de 3 meses.
Incidência75 de pelo menos 1% - Relação de causalidade pelo menos possível ou maior.
A lista a seguir contém reações adversas que ocorreram com incidência75 de pelo menos 1% em estudos clínicos com uma população exposta ao tramadol/paracetamol de 2836 indivíduos em 18 estudos combinados para tratamento da dor aguda e crônica.
Corpo como um todo: astenia88, fadiga76, ondas de calor.
Sistema nervoso central35 e periférico: tontura79, dor de cabeça78, tremor.
Sistema gastrintestinal: dor abdominal, constipação81, diarreia51, dispepsia89, flatulência, boca82 seca, náusea50, vômito83.
Distúrbios psiquiátricos: anorexia84, ansiedade, confusão, euforia, insônia, nervosismo, sonolência.
Pele85 e anexos86: prurido87, erupção60 cutânea61, sudorese49 aumentada.
Entre estes, os eventos adversos mais comuns (5% dos indivíduos) foram náusea50 (14%), tontura79 (10%), sonolência (9%), constipação81 (8%), vômito83 (5%) e dor de cabeça78 (5%). Estes dados estão consistentes com os dados apresentados a seguir.
Eventos adversos clinicamente relevantes que ocorreram com incidência75 menor que 1%.
A lista a seguir contém eventos adversos clinicamente relevantes que ocorreram com incidência75 menor que 1% com tramadol/paracetamol em estudos clínicos.
Corpo como um todo: dor no peito90, rigidez, síncope91, síndrome64 de abstinência, reação alérgica92.
Distúrbios cardiovasculares: hipertensão77, agravamento da hipertensão77, hipotensão93, edema94 dependente.
Sistema nervoso central35 e periférico: ataxia95, convulsões, hipertonia96, enxaqueca97, agravamento da enxaqueca97, contração involuntária98 dos músculos99, parestesia54, estupor, vertigem100.
Sistema gastrintestinal: disfagia101, melena102, edema94 de língua103.
Distúrbios auditivos e vestibulares104: zumbido.
Distúrbios do ritmo e batimentos cardíacos: arritmia105, palpitação106, taquicardia107.
Distúrbios do sistema hepático e biliar: função hepática40 anormal, aumento da TGP (ALT), aumento da TGO (AST).
Distúrbios do metabolismo18 e nutricionais: perda de peso, hipoglicemia108, aumento da fosfatase alcalina109, aumento de peso.
Distúrbios musculoesqueléticos: artralgia110.
Distúrbios plaquetários, hemorrágicos111 e da coagulação112: aumento do tempo de coagulação112, púrpura113.
Distúrbios psiquiátricos: amnésia114, despersonalização, depressão, abuso de drogas, labilidade emocional, alucinação53, impotência115, pesadelos, pensamento anormal.
Distúrbios das células116 vermelhas sanguíneas: anemia117.
Sistema respiratório118: dispneia119, broncoespasmo120.
Distúrbios da pele85 e anexos86: dermatite121, erupção60 cutânea61 eritematosa122.
Sistema urinário123: albuminúria124, distúrbios da micção125, oligúria126, retenção urinária127.
Distúrbios da visão128: visão128 anormal.
Distúrbios das células116 brancas e sistema retículo-endotelial: granulocitopenia e leucocitose129.
Outros eventos adversos clinicamente significativos relatados previamente em estudos clínicos ou em relatos pós- comercialização com cloridrato de tramadol.
Outros eventos adversos que foram relatados durante o tratamento com medicamentos à base de tramadol e cuja relação de causalidade não foi bem determinada incluem: vasodilatação, hipotensão93 ortostática, isquemia130 do miocárdio131, edema pulmonar132, reações alérgicas (incluindo anafilaxia133, urticária134, síndrome de Stevens-Johnson58/síndrome64 da necrólise epidérmica tóxica59), disfunção cognitiva135, dificuldade de concentração, depressão, tendência suicida, hepatite136, insuficiência hepática73 e sangramento gastrintestinal. Relatos de anormalidades em exames laboratoriais incluíram elevação nos testes de creatinina56 e função hepática40. Síndrome serotoninérgica41 (cujos sintomas44 podem incluir alteração da situação mental, hiperreflexia137, febre138, calafrios139, tremor, agitação, diaforese140, convulsões, coma141) foi relatada quando o tramadol foi utilizado concomitantemente com outros agentes serotoninérgicos como inibidores seletivos de recaptação da serotonina e inibidores da MAO30. A experiência pós-comercialização com o uso de produtos que contenham tramadol incluiu raros relatos de “delirium”, miose47, midríase142, transtornos da fala e, muito raramente, de transtornos de movimento. A vigilância pós-comercialização revelou raras alterações do efeito da varfarina, incluindo elevação do tempo de protrombina71. Foram relatados muito raramente casos de hipoglicemia108 em pacientes fazendo uso de tramadol. A maioria dos relatos foi em pacientes com fatores de risco predisponentes, incluindo diabetes143 ou insuficiência renal144, ou em pacientes idosos.
Casos de hiponatremia63 e/ou SIADH foram notificados muito raramente em pacientes que tomaram tramadol, geralmente em pacientes com fatores de risco predisponentes, tais como os idosos ou aqueles que utilizaram medicações concomitantes e que podem causar hiponatremia63.
Outros eventos adversos clinicamente significativos previamente relatados em estudos clínicos ou relatos pós-comercialização com paracetamol.
Reações alérgicas (principalmente erupção60 cutânea61) ou relatos de hipersensibilidade secundária ao paracetamol foram raros e geralmente controlados pela descontinuação do medicamento e, quando necessário, tratamento sintomático145. Houve vários relatos que sugerem que o paracetamol pode produzir hipoprotrombinemia quando administrado com compostos com ação semelhante à varfarina. Em outros estudos, o tempo da protrombina71 não foi alterado.
Foi verificado através do “Netherlands Pharmacovigilance Center Lareb”, consulta ao banco de dados do CNMM – Centro Nacional de Monitorização de Medicamentos e Micromedex® (Drugdex Evaluation), que há registro da reação adversa rubor associada ao uso da substância tramadol.
Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária – NOTIVISA ou à Vigilância Sanitária Estadual ou Municipal.
SUPERDOSE
Sintomas44 e sinais45
Uma vez que Tilestal é uma associação de dois fármacos, o quadro clínico de uma dose excessiva pode incluir sinais45 e sintomas44 de toxicidade39 de tramadol, de paracetamol ou de ambos. Os sintomas44 iniciais do tramadol incluem depressão respiratória e/ou convulsões e do paracetamol, observados dentro das primeiras 24 horas, incluem: irritação gastrintestinal, anorexia84, náusea50, vômito83, mal-estar, palidez e diaforese140.
O tramadol:
As consequências potenciais sérias da superdose do componente tramadol são depressão respiratória, letargia146, coma141, convulsão31, parada cardíaca e morte. Adicionalmente, casos de prolongamento do intervalo QT foram relatados durante superdose.
O paracetamol:
O paracetamol na superdose maciça pode causar toxicidade39 hepática40 em alguns pacientes. Os primeiros sintomas44 após uma superdose potencialmente hepatotóxica podem incluir: irritação gastrintestinal, anorexia84, náuseas147, vômitos148, mal-estar, palidez e diaforese140.
Evidência clínica e laboratorial de toxicidade39 hepática40 pode não ser aparente antes de 48 a 72 horas após a ingestão.
Tratamento
Uma superdose única ou múltipla com Tilestal pode ser uma superdose polimedicamentosa potencialmente letal, e recomenda-se consultar especialistas apropriados, se disponível.
Embora a naloxona reverta alguns, mas não todos, os sintomas44 causados pela superdose com tramadol, o risco de convulsões também aumenta com a administração de naloxona. Com base na experiência com tramadol, não se espera que a hemodiálise149 seja útil em uma superdose porque remove menos de 7% da dose administrada em um período de diálise150 de 4 horas.
No tratamento de uma superdose com Tilestal, deve-se dar atenção inicial à manutenção adequada da ventilação151 juntamente com tratamento geral de suporte. Dado que as estratégias para o controle da superdose evoluem continuamente, é aconselhável entrar em contato com uma central de controle de intoxicação para obter as recomendações mais recentes para o controle de uma superdose. A hipotensão93 é, em geral, hipovolêmica e deve responder à administração de fluidos. Vasopressores e outras medidas de suporte devem ser empregados, conforme necessário. Entubação endotraqueal deve realizada quando necessário, para fornecer respiração assistida. Em pacientes adultos e pediátricos, ou em qualquer indivíduo que apresente uma quantidade desconhecida de paracetamol ingerido ou com uma história questionável ou pouco confiável sobre o momento da ingestão, deve-se obter o nível plasmático de paracetamol e ser tratado com acetilcisteína152. Se um teste não puder ser obtido e a ingestão estimada de paracetamol exceder de 7,5 a 10 gramas para adultos e adolescentes ou 150 mg/kg para crianças, a administração de N-acetilcisteína152 deve ser iniciada e continuada durante um ciclo completo de terapia.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
SÓ PODE SER VENDIDO COM RETENÇÃO DA RECEITA
Registro M.S: 1.1861.0282
Responsável Técnico: Lucinéia Namur – CRF – SP: 31.274
Registrado por:
Ativus Farmacêutica Ltda.
Rua Emílio Mallet, 317 – Sala 1005 – Tatuapé
CEP 03.320-000 – São Paulo/SP
CNPJ 64.088.172/0001-41
Indústria Brasileira
Fabricado por:
Aché Laboratórios Farmacêuticos S.A.
Via Dutra, km 222,2 – CEP 07034-904 – Guarulhos – SP
CNPJ 60.659.463/0001-91
Indústria Brasileira
SAC 0800 771 2010