Iludral (Bula do profissional de saúde)
ZODIAC PRODUTOS FARMACÊUTICOS S/A
IDENTIFICAÇÃO DO MEDICAMENTO
Iludral
levetiracetam
Comprimidos 250 e 750 mg
Medicamento similar equivalente ao medicamento de referência.
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Comprimidos revestidos
Embalagens contendo 14 e 30 comprimidos
USO ORAL
USO ADULTO E PEDIÁTRICO ACIMA DE 6 ANOS
COMPOSIÇÃO:
Cada comprimido de Iludral 250 mg contém:
| levetiracetam | 250 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: amido, povidona, talco, dióxido de silício, estearato de magnésio e Opadry.
Cada comprimido de Iludral 750 mg contém:
| levetiracetam | 750 mg |
| excipiente q.s.p. | 1 comprimido |
Excipientes: amido, povidona, talco, dióxido de silício, estearato de magnésio, óxido de ferro vermelho e Opadry.
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE1
INDICAÇÕES
Iludral® (levetiracetam) é indicado como monoterapia para o tratamento de crises focais/parciais, com ou sem generalização secundária em pacientes a partir dos 16 anos com diagnóstico2 recente de epilepsia3.
Iludral® (levetiracetam) é indicado como terapia adjuvante no tratamento de:
- Crises focais/parciais com ou sem generalização secundária em adultos, adolescentes e crianças com idade superior a 6 anos, com epilepsia3.
- Crises mioclônicas4 em adultos, adolescentes e crianças com idade superior a 12 anos, com epilepsia3 mioclônica5 juvenil.
- Crises tônico-clônicas primárias generalizadas em adultos, adolescentes e crianças com mais de 6 anos de idade, com epilepsia3 idiopática6 generalizada.
RESULTADOS DE EFICÁCIA
Crises focais/parciais em adultos e adolescentes a partir de 16 anos com epilepsia3
Monoterapia
O estudo duplo cego7, com grupo paralelo, de não inferioridade, para monoterapia foi realizado comparando-se o levetiracetam (LEV) e carbamazepina (CBZ) de liberação controlada em pacientes de 16 anos de idade ou acima com diagnóstico2 de epilepsia3 de início recente. As crises foram focais/parciais não provocadas (tipo IA, IB ou IC com clara origem focal) ou crises tônico-clônicas generalizadas (sem clara origem focal), categorizadas de acordo com a Classificação Internacional das Crises e Epilepsias da Liga Internacional Contra a Epilepsia3 (ILAE). O estudo foi realizado em 85 centros de 13 países (Europa e África do Sul).
Ao final do período de triagem de 1 semana, pacientes elegíveis foram estratificados pelo tipo de crise (IA/IB/IC ou IC/IIE sem clara origem focal) e randomicamente atribuídos para receber CBZ CR (n=291) ou LEV (n=285), por até 121 semanas dependendo da resposta. Conservadoramente, uma formulação de liberação controlada (CR) de carbamazepina foi utilizada para minimizar os eventos adversos.
O tratamento foi iniciado com uma titulação de 2 semanas tanto com carbamazepina CR 200 mg/dia ou levetiracetam 500 mg/dia, seguido por uma estabilização de 1 semana nos níveis da dose alvo (carbamazepina CR 400 mg/dia ou levetiracetam 1000 mg/dia). Os pacientes que não apresentaram crises durante o período de avaliação de 26 semanas permaneceram com esta dose neste período e nas 26 semanas seguintes como terapia de manutenção. Se um paciente tivesse uma crise durante o período de avaliação, um escalonamento (feito ao longo de 2 semanas com estabilização de 1 semana) para a dose de nível 2 deveria ser feita (carbamazepina CR 800 mg/dia ou levetiracetam 2000 mg/dia). De modo similar, os pacientes que tiveram uma crise durante o período de avaliação da dose de nível 2 puderam passar por outro escalonamento de dose para carbamazepina 1200 mg/dia ou levetiracetam 3000 mg/dia. Nos níveis de dose 2 e 3, o período de avaliação foi constituído por 26 semanas, seguido por um período de manutenção de 26 semanas. Quinhentos e setenta e nove (579) pacientes foram randomizados. Aproximadamente metade dos pacientes de cada grupo de tratamento completou o estudo (53,6% dos pacientes randomizados com CBZ e 54% dos pacientes randomizados com LEV). A distribuição pela categoria do tipo de crise foi similar em ambos os grupos de tratamento, com cerca de 86,7% dos pacientes classificados por terem experimentado crises focais/parciais com clara origem focal. A maioria dos pacientes permaneceram no nível de dose 1 (81,7% dos pacientes randomizados com CBZ e 73,4% dos pacientes randomizados com LEV na população PP – população avaliada por protocolo).
Um desfecho primário definido prospectivamente foi a proporção de pacientes da população PP há 6 meses livres de crises na última dose avaliada.
Cento e setenta e três (73%) dos pacientes PP no braço LEV estavam livres de crises por pelo menos 6 meses na última dose avaliada, comparado com 171 pacientes (72,8%) no braço CBZ. A diferença absoluta ajustada entre LEV e CBZ (IC 95% bicaudal) obtida de um modelo de regressão logística incluindo um fator para uma categoria de crise como a última avaliada (IA/IB/IC versus IC/IIE) foi igual a 0,2% (-7,8%; 8,2%). O limite inferior do intervalo de confiança (-7,8%) foi acima do limite de não inferioridade determinado pelo protocolo (-15%) para esta análise de eficácia primária e, portanto, LEV pode ser considerado não inferior a CBZ na proporção de sujeitos livres de crises por pelo menos 6 meses na primeira dose avaliada na população PP. Considerando outro desfecho clinicamente significante, 56,6% e 58,5% dos pacientes de LEV e CBZ, respectivamente, ficaram livres de crises por 1 ano.
Terapia adjuvante
A eficácia de levetiracetam como terapia adjuvante (adicionada a outras drogas antiepilépticas) em adultos foi estabelecida em três estudos clínicos multicêntricos, randomizados, duplo cego, placebo8 controlado, em pacientes que tiveram crises focais/parciais
refratárias9 com ou sem generalização secundária. A formulação em comprimidos foi utilizada em todos esses estudos. Nesses estudos, 904 pacientes foram randomizados com placebo8, 1000 mg, 2000 mg ou 3000 mg/dia. Os pacientes inscritos no Estudo 1 ou no Estudo 2 tiveram crises focais/parciais refratárias9 por pelo menos 2 anos e usaram 2 ou mais fármacos antiepilépticos (FAEs) clássicos. Os pacientes incluídos no Estudo 3 tiveram crises refratárias9 por pelo menos 1 ano e utilizaram pelo menos um FAE clássico. No período do estudo, pacientes estavam utilizando um regime de dose estável de pelo menos um e poderiam utilizar no máximo dois FAEs. Durante o período basal, pacientes tiveram pelo menos duas crises focais/parciais durante cada período de 4 semanas.
– Estudo 1
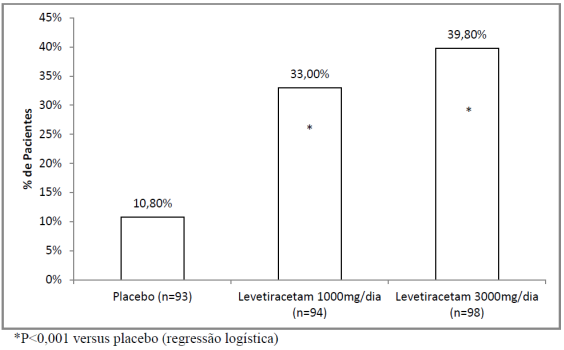
O Estudo 1 foi um estudo duplo cego7, placebo8 controlado, grupo paralelo conduzido em 41 centros nos Estados Unidos comparando levetiracetam 1000 mg/dia (N=98), levetiracetam 3000 mg/dia (N=101) e placebo8 (N=95) administrado em doses igualmente divididas duas vezes ao dia. Após um período basal prospectivo10 de 12 semanas, pacientes foram randomizados para um dos três grupos de tratamento descritos acima. Um tratamento de 18 semanas consistiu em um período de 6 semanas seguidos por um período de avaliação de dose fixa de 12 semanas, durante as quais regimes de FAEs se mantiveram constantes. A medida primária de eficácia foi uma comparação entre grupos da redução percentual da frequência das crises focais/parciais semanais em comparação ao placebo8 ao longo de todo o período de avaliação (considerando as últimas 2 semanas de titulação + 12 semanas do período de avaliação). Variáveis secundárias de resultado incluíram a taxa de respondedores (incidência11 de pacientes com uma redução maior ou igual a 50% a partir do basal na frequência de crises focais/parciais). Os resultados da análise do Estudo 1 estão disponíveis na Tabela 1.
Tabela 1: Redução na média contra placebo8 na frequência semanal de crises focais/parciais no Estudo 1.
|
Placebo8 |
Levetiracetam 1000 mg/dia |
Levetiracetam 3000 mg/dia |
|
| na | 93 | 94 | 98 |
| Percentual de redução na frequência de crise parcial contra o placebo8 | - | 20,9% | 27,7% |
*P≤0,001
a N = nº total de pacientes na população com intenção de tratar (ITT), n = nº de pacientes durante o período de avaliação
A porcentagem de pacientes (eixo y) que alcançaram uma redução maior ou igual a 50% nas taxas de crises semanais a partir do basal na frequência de crises focais/parciais ao longo do período de avaliação (considerando as 2 últimas semanas da titulação + 12 semanas do período de avaliação) nos 3 grupos de estudo (eixo x) está representada na figura 1:
– Estudo 2
O Estudo 2 foi um estudo duplo cego7, placebo8 controlado, cruzado, conduzido em 62 centros na Europa comparando levetiracetam 1000 mg/dia (N=106), levetiracetam 2000 mg/dia (N=106) e placebo8 (N=112) administrado em doses divididas igualmente duas vezes ao dia.
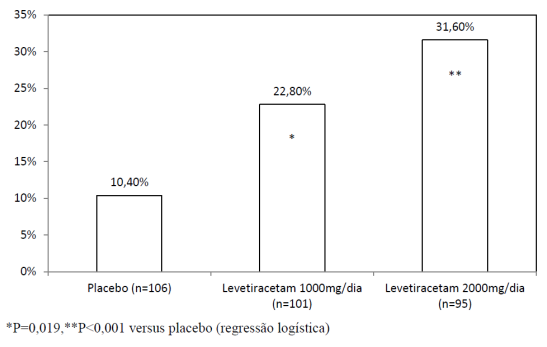
O primeiro período do estudo (Período A) foi desenhado para ser analisado como um estudo de grupo paralelo. Após um período de base prospectivo10 de até 12 semanas, os pacientes foram randomizados em um dos três grupos de tratamento descritos acima. Um período de tratamento de 16 semanas consistiu em um período de titulação de 4 semanas, seguidos por um período de avaliação de dose fixa de 12 semanas, durante as quais regimes concomitantes de FAE foram mantidos constantes. O desfecho primário de eficácia foi uma comparação entre a redução percentual na frequência de crises focais/parciais semanais em relação ao placebo8 durante o período de avaliação. As variáveis secundárias dos resultados incluíram a taxa de resposta (incidência11 de pacientes com uma redução maior ou igual a 50% a partir do basal na frequência de crises focais/ parciais). Os resultados das análises do Período A estão disponíveis na Tabela 2.
Tabela 2: Redução na média contra placebo8 na frequência semanal de crises focais/parciais no Estudo 2: Período A.
|
Placebo8 (Na=112) |
Levetiracetam 1000 mg/dia (Na=106) |
Levetiracetam 3000 mg/dia (Na=106) |
|
| na | 93 | 101 | 95 |
| Percentual de redução na frequência de crise parcial contra o placebo8 | - | 16,4%* | 17,7%** |
*P=0,006, **P=0,003
a N = nº de pacientes na população com intenção de tratar (ITT); n = nº de pacientes na população com intenção de tratar (ITT) durante o período de avaliação.
A porcentagem de pacientes (eixo y) que alcançaram uma redução maior ou igual a 50% nas taxas de crises semanais a partir do basal na frequência de crises focais/parciais ao longo do período de tratamento randomizado12 (titulação + período de avaliação) nos 3 grupos de estudo (eixo x) está representada na figura 2:
– Estudo 3
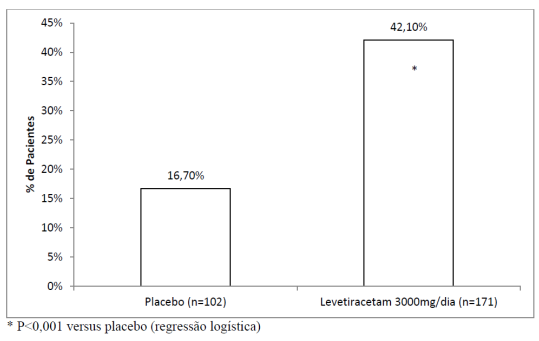
O Estudo 3 foi um estudo duplo cego7, placebo8 controlado, grupo paralelo, conduzido em 47 centros na Europa comparando levetiracetam 3000 mg/dia (N=181) e placebo8 (N=105) administrados em pacientes com crises focais/parciais refratárias9, com ou sem generalização secundária, recebendo somente um FAE concomitante. A droga em estudo foi administrada em duas doses divididas. Após um período de base de 12 semanas, os pacientes foram randomizados em um dos dois grupos de tratamento descritos acima. O período de tratamento de 16 semanas consistiu em um período de titulação de 4 semanas, seguido por um período de avaliação de 12 semanas com dose fixa de levetiracetam administrado como terapia adjuvante (add-on) e um período de 2 semanas para seleção de respondedores, durante o qual doses concomitantes de FAEs foram mantidas constantes. O desfecho primário de eficácia foi a comparação entre grupos da redução percentual da frequência de crises semanais em relação ao placebo8 ao longo de todo o período randomizado12 de avaliação add-on (considerando 12 semanas de avaliação com dose fixa de levetiracetam administrado como terapia adjuvante + 2 semanas do período de seleção de respondedores). As variáveis de desfecho secundário incluíram a taxa de respondedores (incidência11 de pacientes com uma redução maior ou igual a 50% a partir do basal na frequência de crises focais/parciais). A Tabela 3 possui os resultados da análise do Estudo 3.
Tabela 3: Redução na média contra placebo8 na frequência semanal de crises focais/parciais no Estudo 3.
|
Placebo8 (Na=105) |
Levetiracetam 3000 mg/dia (Na=181) |
|
| na | 102 | 171 |
| Percentual de redução na frequência de crise parcial contra o placebo8 | - | 22,2%* |
*P<0,001
a N=nº total de pacientes na população com intenção de tratar (ITT); n=nº de pacientes no período de avaliação add-on
A porcentagem de pacientes (eixo y) que alcançaram uma redução maior ou igual a 50% nas taxas de crises semanais a partir do basal na frequência de crises focais/parciais ao longo do período de avaliação add-on (considerando 12 semanas de avaliação com dose fixa de levetiracetam administrado como terapia adjuvante + 2 semanas do período de seleção de respondedores) nos 2 grupos de estudo (eixo x) está representada na figura 3:
Em uma análise agrupada destes três estudos, a porcentagem de pacientes que alcançaram 50% ou mais de redução a partir do basal na frequência de crises focais/parciais por semana em uma dose estável (12/14 semanas) foi de 27,7%, 31,6% e 41,3% para pacientes13 com 1000, 2000 ou 3000 mg de levetiracetam respectivamente, e 12,6% para pacientes13 recebendo placebo8.
Crises focais/parciais em pacientes pediátricos com epilepsia3
– População pediátrica (4 a 16 anos de idade)
A eficácia de levetiracetam como terapia adjuvante (juntamente com outras drogas antiepilépticas) em pacientes pediátricos foi estabelecida em um estudo multicêntrico, randomizado12, duplo cego, placebo8-controlado, conduzido em 60 centros na América do Norte, em crianças de 4 a 16 anos de idade com crises focais/parciais não controladas por fármacos antiepilépticos (FAEs) padrão. Pacientes elegíveis com uma dose estável de 1-2 FAEs, que ainda vivenciaram pelo menos 4 crises focais/parciais durante as 4 semanas antes da triagem, assim como pelo menos 4 crises focais/parciais em cada um dos dois períodos de 4 semanas do período basal, foram randomizados para receber levetiracetam ou placebo8. A população inscrita incluiu 198 pacientes (levetiracetam = 101, placebo8 = 97) com crises refratárias9 focais/parciais, com ou sem generalização secundária. O estudo consistiu em um período basal de 8 semanas e um período de titulação de 4 semanas seguido por um período de avaliação de 10 semanas. O doseamento teve início com uma dose de 20 mg/kg/dia em duas doses divididas. Durante o período de tratamento, as doses de levetiracetam foram ajustadas em incrementos de 20 mg/kg/dia, com intervalos de 2 semanas para a dose alvo de 60 mg/kg/dia. O desfecho primário de eficácia foi a comparação entre grupos do percentual de redução na frequência de crises focais/parciais semanais em relação ao placebo8 durante todo o período randomizado12 de 14 semanas (titulação + período de avaliação). As variáveis de desfecho secundário incluíram a taxa de respondedores (incidência11 de pacientes com redução maior ou igual a 50% a partir do basal na frequência de crises focais/parciais por semana). Na tabela 4 estão disponibilizados os resultados deste estudo:
Tabela 4: Redução na média contra placebo8 na frequência semanal de crises focais/parciais.
| Placebo8 (na=97) | Levetiracetam (na=101) | |
| na | 102 | 171 |
| Percentual de redução na frequência de crise parcial contra o placebo8 | - | 22,2%* |
*P=0,0002
A porcentagem de pacientes (eixo y) que alcançaram uma redução maior ou igual a 50% nas taxas de crises semanais a partir do basal na frequência de crises focais/parciais ao longo de todo o período de tratamento randomizado12 (titulação + período de avaliação) dentro dos dois grupos de tratamento (eixo x) é apresentada na figura 4.

Com a continuidade do tratamento de longo prazo, 11,4% dos pacientes ficaram livres de crises por pelo menos 6 meses e 7,2% ficaram livres de crises por pelo menos 1 ano.
– Crises mioclônicas4 em pacientes ≥ 12 anos de idade
A eficácia de levetiracetam como terapia adjuvante (juntamente com outras drogas antiepilépticas) em pacientes de 12 anos de idade ou mais com epilepsia3 mioclônica5 juvenil foi estabelecida em um estudo multicêntrico, randomizado12, duplo cego, placebo8-controlado, conduzido em 37 centros de 14 países. Pacientes elegíveis com uma dose estável de 1 FAE que vivenciaram uma ou mais crises mioclônicas4 por dia por pelo menos 8 dias durante o período basal de 8 semanas foram randomizados tanto para levetiracetam quanto para placebo8. A população inscrita incluiu 120 pacientes (levetiracetam = 60, placebo8 = 60) com epilepsia3 idiopática6 generalizada, que incluiu epilepsia3 mioclônica5 juvenil, epilepsia3 tipo ausência juvenil ou epilepsia3 com crises tônico-clônicas generalizadas ao despertar. A maioria era de pacientes com epilepsia3 mioclônica5 juvenil. Pacientes foram titulados por 4 semanas com uma dose alvo de 3000 mg/dia e tratados com uma dose estável de 3000 mg/dia por 12 semanas (período de avaliação). A droga de estudo foi administrada em duas doses. O desfecho primário de eficácia foi a proporção de pacientes com uma redução de pelo menos 50% no número de dias por semana com uma ou mais crises mioclônicas4 durante o período de tratamento (titulação + período de avaliação) quando comparado com o basal. Variáveis de desfecho secundário incluíram ausência de crise (crises mioclônicas4) e taxa de resposta na frequência de crise mioclônica5 por semana durante o período de tratamento. A tabela 5 apresenta os resultados deste estudo para o desfecho primário de eficácia.
Tabela 5: Taxa de resposta (redução maior ou igual a 50% a partir do basal) em dias de crise mioclônica5 por semana
| Placebo8 (na=60) | Levetiracetam (na=60) | |
| Percentual de respostas | 23,3% | 58,3%* |
Com a continuidade do tratamento a longo prazo, 28,6% dos pacientes ficaram livres das crises mioclônicas4 por pelo menos 6 meses e 21% ficaram livres das crises mioclônicas4 por pelo menos 1 ano.
– Crises tônico-clônicas primárias generalizadas em pacientes ≥ 6 anos de idade
A eficácia de levetiracetam como terapia adjuvante (juntamente com outras drogas antiepilépticas) em pacientes de 6 anos de idade ou mais com epilepsia3 idiopática6 generalizada com crises tônico-clônicas primárias generalizadas (PGTC) foi estabelecida em um estudo multicêntrico, randomizado12, duplo cego, placebo8-controlado, conduzido em 50 centros de 8 países. Pacientes elegíveis com uma dose estável de 1 ou 2 FAEs que vivenciaram pelo menos 3 crises PGTC durante o período basal combinado (pelo menos uma convulsão14 PGTC durante 4 semanas antes do período basal prospectivo10 e pelo menos uma crise PGTC durante as 4 semanas do período basal prospectivo10) foram randomizados para levetiracetam ou para placebo8. O período basal combinado de 8 semanas é referido como “linha basal” no restante desta seção. A população incluída foi de 164 pacientes (levetiracetam = 80, placebo8 = 84) com epilepsia3 idiopática6 generalizada (predominantemente epilepsia3 mioclônica5 juvenil, epilepsia3 ausência juvenil, epilepsia3 ausência infantil ou crises generalizadas tônico-clônicas ao despertar). Cada uma dessas síndromes de epilepsia3 idiopática6 generalizada foi bem representada nesta população de pacientes. Os pacientes foram titulados por 4 semanas com uma dose alvo de 3000 mg/dia para adultos ou uma dose alvo pediátrica de 60 mg/kg/dia e tratados com uma dose estável de 3000 mg/dia (ou 60 mg/kg/dia para crianças) por 20 semanas (período de avaliação). A droga de estudo foi administrada em duas doses igualmente divididas/dia.
O desfecho primário de eficácia foi a redução percentual a partir do basal na frequência das crises PGTC semanais para os grupos de tratamento com levetiracetam e placebo8 durante o período de tratamento (titulação + período de avaliação). Houve uma diminuição estatisticamente significativa a partir do basal da frequência de PGTC nos pacientes tratados com levetiracetam em comparação aos pacientes tratados com placebo8. A significância estatística versus placebo8 indica um valor p de <0,05.
Tabela 6: Redução percentual média na frequência de crises PGTC por semana
|
Placebo8 |
Levetiracetam |
|
| Efeito do tratamento na redução percentual da frequência de crises PGTC | - | 28,3% |
*P=0,004
A porcentagem de pacientes (eixo y) que alcançaram uma redução maior ou igual a 50% nas taxas de crises semanais a partir do basal na frequência de crises PGTC durante todo o período de tratamento randomizado12 (titulação + período de avaliação) nos dois grupos de tratamento (eixo x) é apresentada na figura 6.

Com a continuidade do tratamento a longo prazo, 47,4% dos pacientes ficaram livres das crises tônico-clônicas por pelo menos 6 meses e 31,5% ficaram livres das crises tônico-clônicas por pelo menos 1 ano.
Referências:
- Clinical study report N01061: A multicenter, double-blind, randomized, parallel-group, positive controlled trial comparing the efficacy and safety of levetiracetam (1000 to 3000 mg/day oral b.i.d.) to carbamazepine (400 to 1200 mg/day oral b.i.d.), used as monotherapy for up to a maximum of 121 weeks in subjects (≥ 16 years) newly or recently diagnosed as suffering from epilepsy, and experiencing partial or generalized tonic-clonic seizures.
- Clinical study report N132: Evaluation of the efficacy and tolerability of ucb L059 (500 and 1500 mg b.i.d., tablets) add-on treatment in epileptic patients with partial onset seizures: a 38- week double-blind placebo8-controlled parallel multicenter trial.
- Clinical study report N051: Evaluation of the efficacy and tolerability of ucb L059 (500 and 1000 mg b.i.d., tablets) add-on treatment in refractory epileptic patients with partial onset seizures: a 32-week double-blind placebo8-controlled crossover multicenter trial.
- Clinical study report N138: Evaluation of the efficacy and tolerability of ucb L059 (1500 mg b.i.d., 500 mg tablets) monotherapy in epileptic patients with complex partial onset seizures, having experienced improved seizure control under add-on treatment.
- Clinical study report N159: Evaluation of The Efficacy and Tolerability of Levetiracetam Add-On Treatment in Refractory Pediatric Patients With Partial Onset Seizures: A 28-Week Double- Blind, Placebo8-Controlled Multi-Center Trial (4 years to <16 years).
- Clinical study report N166 : A double-blind, multicenter, randomized, placebo8-controlled study to evaluate the efficacy and safety of levetiracetam (LEV) (oral tablets of 500 mg b.i.d.), at a dose of 3000 mg/day as adjunctive treatment in adolescents (≥ 12 years) and adults (≤ 65 years) suffering from idiopathic generalized epilepsy with myoclonic seizures.
- Clinical study report N01057: A double-blind, multicenter, randomized, placebo8-controlled study to evaluate the efficacy and safety of adjunctive treatment with 3000 mg/day (pediatric target dose of 60 mg/kg/day) oral levetiracetam (LEV) (166, 250, and 500 mg tablets), in adult and pediatric subjects (4-65 years) suffering from idiopathic generalized epilepsy with primary generalized tonic- clonic (PGTC) seizures.
CARACTERÍSTICAS FARMACOLÓGICAS
Propriedades farmacodinâmicas:
A substância ativa, levetiracetam, é um derivado da pirrolidona (enantiômero-S de ?-etil-2-oxo-1-pirrolidina acetamida), quimicamente não relacionada com substâncias ativas antiepilépticas existentes.
Mecanismo de ação: O mecanismo de ação do levetiracetam ainda não foi completamente elucidado, mas parece ser diferente dos mecanismos antiepilépticos já existentes. Experiências in vitro e in vivo sugerem que o levetiracetam não altera as características básicas da célula15 nem a neurotransmissão normal.
Estudos in vitro mostram que o levetiracetam afeta os níveis de Ca+2intraneuronais, pela inibição parcial das correntes de Ca+2das reservas intraneuronais. Adicionalmente, reverte parcialmente as reduções nas correntes de entrada do GABA16 e da glicina, induzidas pelo zinco e pelas ?-carbolinas. Além disto, estudos in vitro demonstraram que o levetiracetam se liga a um local específico no tecido17 cerebral dos roedores. Este local de ligação é a proteína 2A da vesícula18 sináptica, que se pensa estar envolvida na fusão das vesículas19 e na exocitose20 dos neurotransmissores. O levetiracetam e análogos relacionados mostram uma ordem de grandeza de afinidade para a ligação com proteína 2A da vesícula18 sináptica, que se correlaciona com a potência da sua proteção anticonvulsivante, no modelo audiogênico de epilepsia3 em camundongo. Este resultado sugere que a interação entre o levetiracetam e a proteína 2A da vesícula18 sináptica parece contribuir para o mecanismo de ação antiepiléptica do fármaco21.
Efeitos farmacodinâmicos: O levetiracetam induz proteção contra a crise em um grande número de modelos animais de crises focais/parciais e primárias generalizadas sem apresentar um efeito pró-convulsivante. O metabólito22 primário é inativo. No homem, uma atividade em ambas as condições de epilepsia3 parcial e generalizada (descarga epileptiforme23/resposta fotoparoxística) confirmou o perfil farmacológico pré- clínico de largo espectro.
Propriedades farmacocinéticas: O levetiracetam é um composto altamente solúvel e permeável. O perfil farmacocinético é linear com uma baixa variabilidade intra e inter-individual. Não há alteração da depuração após administração repetida. Não há evidência de qualquer variabilidade relevante relacionada com o sexo, raça ou ritmo circadiano24. O perfil farmacocinético é comparável em voluntários saudáveis e em pacientes com epilepsia3.
Devido à sua absorção completa e linear, os níveis plasmáticos podem ser deduzidos a partir da dose oral de levetiracetam expressa em mg/kg de peso corporal. Deste modo, não é necessária a monitorização dos níveis plasmáticos de levetiracetam.
Foi demonstrada uma correlação significativa entre as concentrações na saliva e no plasma25, em adultos e crianças (a relação entre concentrações na saliva/plasma25 variou de 1 a 1,7 para a formulação dos comprimidos orais e 4 horas após administração para a formulação da solução oral).
Absorção: O levetiracetam é rapidamente absorvido após administração por via oral. A biodisponibilidade oral absoluta é próxima a 100%.
Os picos das concentrações plasmáticas (Cmáx) são atingidos 1,3 horas após a administração. O estado de equilíbrio é atingido 2 dias após um esquema de administração de duas vezes por dia.
Os picos das concentrações (Cmáx) são habitualmente de 31 e 43 ?g/mL, após uma dose única de 1000 mg e de uma dose repetida de 1000 mg duas vezes por dia, respectivamente.
A extensão de absorção é independente da dose e não é alterada pelos alimentos.
Distribuição: Não existem dados disponíveis sobre a distribuição nos tecidos em humanos.
Nem o levetiracetam, nem o metabólito22 primário se ligam significativamente às proteínas26 plasmáticas (<10%).
O volume de distribuição do levetiracetam é aproximadamente de 0,5 a 0,7 L/kg, um valor próximo do volume de água corporal total.
Biotransformação: O levetiracetam não é extensivamente metabolizado nos humanos. A principal via metabólica (24% da dose) é uma hidrólise enzimática do grupo acetamida. A produção do metabólito22 primário, ucb L057, não é suportado pelas isoformas do citocromo hepático P450. A hidrólise do grupo acetamida foi determinável em um vasto número de tecidos incluindo as células sanguíneas27. O metabólito22 ucb L057 é farmacologicamente inativo.
Dois metabólitos28 menores também foram identificados. Um deles foi obtido por hidroxilação do anel pirrolidona (1,6% da dose) e o outro pela abertura do anel pirrolidona (0,9% da dose).
Outros componentes não identificados foram responsáveis por apenas 0,6% da dose.
Não foi evidenciada qualquer interconversão enantiomérica in vivo para o levetiracetam ou para o seu metabólito22 primário.
O levetiracetam e seu metabólito22 primário tem mostrado, in vitro, não inibir as isoformas principais do citocromo hepático humano P450 (CYP3A4, 2A6, 2C9, 2D6, 2C19, 2D6, 2E1 e 1A2), a glucuronil transferase (UGT1A1 e UGT1A6) e as atividades da epóxido- hidroxilase. Além disso, o levetiracetam não afeta a glucuronidação in vitro do ácido valpróico.
Em hepatócitos humanos em cultura, o levetiracetam teve efeito mínimo ou ausência de efeito sobre a conjugação do etinilestradiol ou CYP1A1/2. O levetiracetam provocou indução moderada sobre CYP2B6 e CYP3A4 em altas concentrações (680 ?g/mL), porém, em concentrações aproximadas do Cmáx seguindo-se duas doses diárias de 1500 mg, os efeitos não foram considerados biologicamente relevantes. Deste modo, a interação de levetiracetam com outras substâncias, ou vice-versa, é pouco provável.
Eliminação: A meia-vida plasmática em adultos foi 7 ±1 hora e não se alterou com a dose, a via de administração ou com a administração repetida. A depuração corporal total média foi 0,96 mL/min/kg.
A principal via de excreção é a via urinária, sendo responsável por 95% da dose (aproximadamente 93% da dose foi excretada no intervalo de 48 horas). A excreção via fecal foi responsável por apenas 0,3% da dose.
A excreção urinária cumulativa do levetiracetam e do seu metabólito22 primário foi responsável por 66% e 24% da dose, respectivamente durante as primeiras 48 horas.
A depuração renal29 do levetiracetam e do ucb L057 é de 0,6 e 4,2 mL/min/kg, respectivamente, indicando que o levetiracetam é excretado por filtração glomerular com subsequente reabsorção tubular e que o metabólito22 primário é igualmente excretado por secreção tubular ativa, em adição à filtração glomerular. A eliminação do levetiracetam está correlacionada com a depuração da creatinina30.
Populações especiais
Idosos: Nos idosos, a meia-vida é aumentada em cerca de 40% (10 a 11 horas). Isto está relacionado com a diminuição da função renal29 nestes indivíduos (vide seção Posologia e Modo de Usar).
População pediátrica (Crianças de 4 aos 12 anos): Após uma administração oral de dose única (20 mg/dia) a crianças epiléticas, a meia-vida do levetiracetam foi de 6 horas. A depuração corporal aparente foi de 1,43 mL/min/kg.
Após uma administração de doses orais repetidas (20 a 60 mg/dia) a crianças epiléticas (4 a 12 anos), o levetiracetam foi rapidamente absorvido. O pico da concentração plasmática foi observado 0,5 a 1 hora após a administração. Foram observados aumentos lineares e proporcionais à dose para o pico da concentração plasmática e para a área sob a curva. A meia-vida de eliminação foi de, aproximadamente, 5 horas. A depuração corporal aparente foi de 1,1 mL/min/kg.
Na análise farmacocinética populacional efetuada em pacientes com idades entre 1 mês e 16 anos após administração oral, o peso corporal teve uma correlação significativa com a depuração aparente (a depuração aumentou com o aumento do peso corporal) e com o volume de distribuição aparente. A idade também teve influência em ambos os parâmetros. Este efeito foi mais pronunciado nas crianças mais novas, diminuindo com o aumento da idade, até se tornar negligenciável por volta dos 4 anos de idade.
Nas análises farmacocinéticas populacionais verificou-se um aumento de cerca de 20% na depuração aparente do levetiracetam quando este foi coadministrado com fármaco21 antiepiléptico (FAE) indutor enzimático.
Comprometimento renal29: A depuração corporal aparente de levetiracetam e do seu metabólito22 primário está correlacionada com a depuração da creatinina30. Recomenda-se, além disso, o ajuste da dose diária de manutenção de levetiracetam, com base na depuração de creatinina30 em pacientes com comprometimento renal29 moderado e grave (vide seção Posologia e Modo de Usar).
Nos indivíduos adultos em fase anúrica terminal, a meia-vida foi aproximadamente 25 e 3,1 horas, durante períodos inter-diálise31 e intra-diálise31, respectivamente.
A remoção fracional do levetiracetam foi de 51%, durante uma sessão comum de diálise31 de 4 horas.
Comprometimento hepático: Em indivíduos com comprometimento hepático leve (Child-Pugh A) e moderado (Child-Pugh B), a farmacocinética de levetiracetam permaneceu inalterada. Na maioria dos indivíduos com comprometimento hepático grave (Child-Pugh C), a depuração corpórea total foi de 50% comparado a pacientes normais, mas a diminuição da depuração renal29 foi responsável pela maior parte da diminuição (vide seção Posologia e Modo de Usar).
CONTRAINDICAÇÕES
Hipersensibilidade ao princípio ativo ou a outros derivados da pirrolidona ou a qualquer um dos excipientes.
ADVERTÊNCIAS E PRECAUÇÕES
Descontinuação
De acordo com a prática clínica atual, se Iludral® (levetiracetam) tiver que ser descontinuado, recomenda-se que a sua descontinuação seja efetuada de forma gradual (exemplo: nos adultos e adolescentes com peso superior a 50 kg: reduções de 500 mg duas vezes ao dia, a cada duas a quatro semanas; nas crianças com mais de 6 meses de idade e adolescentes com menos de 50 kg de peso, a diminuição da dose não deve exceder 10 mg/kg duas vezes ao dia, a cada duas semanas).
Contagem de células sanguíneas27
Casos de diminuição na contagem de células sanguíneas27 (neutropenia32, agranulocitose33, leucopenia34, trombocitopenia35 e pancitopenia36) foram descritos em associação à administração de levetiracetam. Contagens completas de células sanguíneas27 são recomendadas em pacientes apresentando fraqueza, pirexia37 (febre38), infecções39 recorrentes ou distúrbios de coagulação40 (vide item 9. REAÇÕES ADVERSAS).
Insuficiência renal41
A administração de Iludral® (levetiracetam) em pacientes com comprometimento renal29 poderá necessitar de um ajuste da dose. Em pacientes com comprometimento grave da função hepática42, recomenda-se a avaliação da função renal29 antes de selecionar a dose (vide seção Posologia e Modo de Usar).
Suicídio
Foram notificados suicídio, tentativa de suicídio e ideias e comportamento suicida em pacientes tratados com levetiracetam.
Os pacientes e seus cuidadores devem ser aconselhados a contatar o médico assim que surjam sinais43 de depressão e/ou ideias e comportamento suicida.
Transtornos psiquiátricos e alterações no comportamento
O levetiracetam pode causar alterações no comportamento (por exemplo: agressividade, agitação, raiva44, ansiedade, apatia45, depressão, hostilidade e irritabilidade) e sintomas46 psicóticos. Os pacientes tratados com levetiracetam devem ser monitorizados quanto a sinais43 e sintomas46 psiquiátricos.
Agravamento de crises epilépticas
Pode ser observada uma reação paradoxal47 do agravamento de crises epilépticas, especialmente ao iniciar o tratamento ou no aumento da dose.
Fertilidade, Gravidez48 e Lactação49
O levetiracetam não deve ser usado durante a gravidez48 a menos que seja clinicamente necessário.
Dados de pós-comercialização de alguns registros de gravidez48 documentaram os resultados em mais de 1000 mulheres expostas à monoterapia com levetiracetam durante o primeiro trimestre de gravidez48. No geral, estes dados não sugerem um aumento substancial no risco de malformações50 importantes, embora este risco não possa ser completamente excluído. O tratamento com múltiplos medicamentos antiepilépticos está associado a um risco maior de malformações50 em comparação à monoterapia e, portanto, esta informação deve ser considerada.
Estudos em animais revelaram toxicidade51 reprodutiva (vide Dados de segurança pré-clínica).
Tal como acontece com outros medicamentos antiepilépticos, as alterações fisiológicas52 durante a gravidez48 podem afetar a concentração de levetiracetam. Houve relatos de diminuição na concentração de levetiracetam durante a gravidez48. Esta diminuição é mais pronunciada durante o terceiro trimestre (até 60% da concentração basal antes da gravidez48). A descontinuação dos tratamentos com antiepilépticos pode resultar na exacerbação da doença, o que pode ser perigoso para a mãe e para o feto53. A gravidez48 de mulheres em tratamento com Iludral® (levetiracetam) deve ser monitorada.
Categoria de risco na gravidez48: C
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
O levetiracetam é excretado no leite humano materno. Portanto, a amamentação54 não é recomendada. No entanto, se o tratamento com levetiracetam for necessário durante a amamentação54, o benefício/risco do tratamento deve ser avaliado tendo em consideração a importância da amamentação54.
Efeitos na habilidade de dirigir e operar máquinas
Não foram estudados os efeitos sobre a capacidade de conduzir veículos e utilizar máquinas.
Devido a possíveis sensibilidades individuais diferentes, alguns pacientes poderão apresentar sonolência ou outros sintomas46 relacionados com o Sistema Nervoso Central55, especialmente no início do tratamento ou após um aumento da dose. Assim sendo, recomenda-se precaução nos pacientes que executam tarefas especializadas, por exemplo, condução de veículos ou utilização de máquinas.
Dados de segurança pré-clínica
Os dados pré-clínicos não revelam riscos especiais em humanos, segundo estudos convencionais de farmacologia56 de segurança, genotoxicidade e carcinogenicidade.
Eventos adversos não observados nos estudos clínicos, mas verificados em ratos e em menor grau em camundongos, em níveis de exposição semelhantes aos níveis de exposição em humanos e com possível relevância para o uso clínico foram: alterações hepáticas57 indicando uma resposta adaptativa, tais como um aumento de peso e hipertrofia58 centrolobular, infiltração lipídica e aumento das enzimas hepáticas59 no plasma25.
Carcinogênese
O levetiracetam foi administrado em ratos durante 104 semanas em doses de 50, 300 e 1800 mg/kg/dia. A dose mais alta corresponde a 6 vezes a dose máxima diária recomendada para humanos (3000 mg) em mg/m2. Esta dose também levou a uma exposição sistêmica (AUC60) de aproximadamente 6 vezes a obtida com a dose diária máxima em humanos. Não houve evidência de carcinogenicidade. Dois estudos foram conduzidos em camundongos. Em um estudo, os camundongos receberam levetiracetam na dieta por 80 semanas em níveis de dose de 60, 240 e 960 mg/kg/dia (a dose mais alta é equivalente a 2 vezes a dose máxima diária em mg/m2 ou em termos de exposição). No segundo estudo, os camundongos receberam levetiracetam através de sonda oral durante 2 anos em níveis de dose de 1000, 2000 e 4000 mg/kg/dia. Devido à baixa sobrevida61 com a dose de 4000 mg/kg/dia, neste estudo, a dose mais alta foi reduzida para 3000 mg/kg/dia (equivalente a 12 vezes a dose máxima diária recomendada em humanos).
Nenhum dos estudos mostrou evidência de carcinogenicidade.
Foram efetuados dois estudos de desenvolvimento embrio-fetal (EFD) em ratos com doses de 400, 1200 e 3600 mg/kg/dia. Com a dose de 3600 mg/kg/dia observou-se, em apenas um dos dois estudos EFD, uma ligeira diminuição no peso fetal associada a um aumento marginal de anomalias menores/alterações esqueléticas. Não foram observados efeitos sobre a mortalidade62 embrionária e
não houve aumento da incidência11 de malformações50. O NOAEL (nível de efeito adverso não observável) foi de 3600 mg/kg/dia para ratas grávidas (doze vezes a dose máxima diária recomendada para humanos em mg/m2) e 1200 mg/kg/dia para fetos.
Foram efetuados quatro estudos de desenvolvimento embrio-fetal em coelhos abrangendo as doses de 200, 600, 800, 1200 e 1800 mg/kg/dia. A dose de 1800 mg/kg/dia induziu uma toxicidade51 maternal marcada e uma diminuição no peso fetal associada ao aumento de incidência11 de fetos com anomalias cardiovasculares/esqueléticas. O NOAEL foi < 200 mg/kg/dia para as mães e 200 mg/kg/dia para os fetos (igual à dose máxima diária recomendada para humanos, considerando mg/m2).
Foi efetuado um estudo de desenvolvimento peri e pós-natal em ratos com doses de levetiracetam de 70, 350 e 1800 mg/kg/dia. O NOAEL foi ? 1800 mg/kg/dia para as fêmeas F0, e para a sobrevivência63, crescimento e desenvolvimento da ninhada F1 até o desmame (6 vezes a dose máxima diária recomendada para humanos, considerando mg/m2).
Estudos animais realizados em ratos e cães recém-nascidos e jovens demonstraram que não ocorreram efeitos adversos sobre nenhum dos desfechos padronizados para avaliação do desenvolvimento e de maturação, com doses de até 1800 mg/kg/dia (6-17 vezes a dose máxima diária recomendada para humanos, considerando mg/m2).
INTERAÇÕES MEDICAMENTOSAS
Medicamentos antiepilépticos
Dados indicam que o levetiracetam não influencia as concentrações séricas de medicamentos antiepilépticos existentes (fenitoína, carbamazepina, ácido valpróico, fenobarbital, lamotrigina, gabapentina e primidona) e que estes medicamentos antiepilépticos não influenciam a farmacocinética de levetiracetam.
A depuração de levetiracetam foi 22% mais alta em crianças utilizando FAEs indutores enzimáticos comparado com crianças que não estavam utilizando FAEs indutores enzimáticos. O ajuste de dose não é recomendado. O levetiracetam não teve qualquer efeito nas concentrações plasmáticas de carbamazepina, valproato, topiramato ou lamotrigina.
Probenecida: A probenecida (500 mg quatro vezes ao dia), um agente bloqueador da secreção tubular renal29, mostrou inibir a depuração renal29 do metabólito22 primário, mas não a do levetiracetam. Contudo, a concentração deste metabólito22 permanece baixa. Espera-se que outros medicamentos excretados por secreção tubular ativa possam também reduzir a depuração renal29 do metabólito22. O efeito do levetiracetam sobre o probenecida não foi estudado e o efeito de levetiracetam sobre outros medicamentos secretados ativamente, como por exemplo, AINEs, sulfonamidas e metotrexato é desconhecido.
Contraceptivos orais e outras interações farmacocinéticas: Levetiracetam 1000 mg por dia não influenciou a farmacocinética dos contraceptivos orais (etinilestradiol e levonorgestrel); os parâmetros endócrinos (hormônio64 luteinizante e progesterona) não sofreram alteração. Levetiracetam 2000 mg por dia não influenciou a farmacocinética da digoxina e da varfarina; os tempos de protrombina65 não sofreram alteração. A coadministração com digoxina, contraceptivos orais e varfarina não influenciou a farmacocinética do levetiracetam.
Antiácidos66: Não estão disponíveis dados relativos à influência dos antiácidos66 sobre a absorção do levetiracetam.
Laxantes67: Foram observados relatos isolados de diminuição de eficácia quando o laxante68 osmótico69 macrogol foi administrado concomitantemente a levetiracetam oral. Assim, a administração oral de macrogol não deve ser realizada dentro de 1 hora (antes ou após) da administração de levetiracetam.
Alimentos e álcool: A extensão de absorção do levetiracetam não sofreu qualquer alteração com a ingestão de alimentos, mas a taxa de absorção diminuiu ligeiramente.
Não estão disponíveis dados sobre a interação do levetiracetam com o álcool.
CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO
Cuidados de conservação
Iludral® (levetiracetam) tem prazo de validade de 36 meses a partir da data de fabricação, devendo ser armazenado em temperatura ambiente (15–30°C).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
- Iludral® (levetiracetam) de 250 mg: comprimido revestido oblongo, biconvexo, ranhurado e de cor branca, com a inscrição L e 250 em um dos lados.
- Iludral® (levetiracetam) de 750 mg: comprimido revestido oblongo, biconvexo, ranhurado e de cor rosa com a inscrição L e 750 em um dos lados.
Antes de usar, observe o aspecto do medicamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
POSOLOGIA E MODO DE USAR
Modo de usar
Os comprimidos revestidos devem ser tomados por via oral, engolidos com líquido. Iludral® (levetiracetam) pode ser ingerido com ou sem comida. A dose diária é administrada em duas doses igualmente divididas (a cada 12 horas), aproximadamente no mesmo horário de cada dia.
Posologia
– Doses para Monoterapia no tratamento de crises focais/parciais, com ou sem generalização secundária em pacientes a partir dos 16 anos com diagnóstico2 recente de epilepsia3.
A dose inicial recomendada é de 250 mg duas vezes ao dia, a qual poderá ser aumentada para uma dose terapêutica70 inicial de 500 mg duas vezes ao dia, após duas semanas. A dose pode ainda ser aumentada em incrementos de 250 mg duas vezes ao dia, a cada duas semanas, dependendo da resposta clínica. A dose máxima é de 1500 mg duas vezes ao dia.
Não foram conduzidos estudos clínicos para Monoterapia no tratamento de crises focais/parciais, com ou sem generalização secundária em pacientes com menos de 16 anos e diagnóstico2 recente de epilepsia3 (vide Resultados de Eficácia).
Doses para Terapia adjuvante no tratamento de:
- Crises focais/parciais com ou sem generalização secundária em adultos, adolescentes e crianças com idade superior a 6 anos, com epilepsia3.
- Crises mioclônicas4 em adultos, adolescentes e crianças com idade superior a 12 anos, com epilepsia3 mioclônica5 juvenil.
- Crises tônico-clônicas primárias generalizadas em adultos, adolescentes e crianças com mais de 6 anos de idade, com epilepsia3 idiopática6 generalizada.
Terapia adjuvante em adultos (≥ 18 anos) e adolescentes (12 a 17 anos) com peso igual ou superior a 50 kg.
A dose terapêutica70 inicial é de 500 mg/duas vezes ao dia. Esta dose poderá ser iniciada no primeiro dia de tratamento.
Dependendo da resposta clínica e tolerabilidade, a dose diária poderá ser aumentada até o máximo de 1500 mg/duas vezes ao dia. A alteração das doses pode ser efetuada com aumentos ou reduções de 500 mg/duas vezes ao dia, a cada duas a quatro semanas.
Terapia adjuvante em crianças (dos 6 aos 11 anos) e adolescentes (dos 12 aos 17 anos) com peso inferior a 50 kg. A dose terapêutica70 inicial é de 10 mg/kg duas vezes ao dia.
Dependendo da resposta clínica e tolerabilidade, a dose pode ser aumentada até 30 mg/kg duas vezes ao dia. A alteração das doses não deve exceder aumentos ou reduções de 10 mg/kg duas vezes ao dia, a cada duas semanas. Deve ser utilizada a dose eficaz mais baixa.
A posologia em crianças com peso igual ou superior a 50 kg é igual à dos adultos.
Recomendações posológicas para crianças e adolescentes (a partir de 6 anos e com peso inferior a 50 kg):
| Peso | Dose inicial: 10mg/kg duas vezes ao dia | Dose máxima: 30 mg/kg duas vezes ao dia |
|---|---|---|
| 20 kg(1) | 200 mg duas vezes ao dia | 600 mg duas vezes ao dia |
| 25 kg | 250 mg duas vezes ao dia | 750 mg duas vezes ao dia |
| A partir de 50 kg(2) | 500 mg duas vezes ao dia | 1500 mg duas vezes ao dia |
(1) Crianças com peso igual ou inferior a 25 kg devem, preferencialmente, iniciar o tratamento com levetiracetam, 100 mg/mL solução oral.
(2) A posologia em crianças e adolescentes com 50 kg ou mais é igual à dos adultos.
A forma farmacêutica comprimido revestido não é adaptada para bebês71 e crianças com menos de 6 anos. A solução oral é a forma farmacêutica ideal para o uso de levetiracetam nesta população.
Além disso, as concentrações disponíveis de Iludral® (levetiracetam) comprimidos revestidos não são apropriadas para o tratamento inicial em crianças com menos de 25 kg, para pacientes13 incapazes de deglutir72 comprimidos ou para administração de doses menores que 250 mg. Em todas estas situações deve ser utilizada a solução oral de levetiracetam.
Ajustes de dose para populações especiais
Idosos (a partir de 65 anos): É recomendado um ajuste de dose em pacientes idosos com alteração da função renal29 (vide abaixo).
Pacientes com comprometimento renal29: A dose diária de levetiracetam deverá ser individualizada de acordo com a função renal29, pois a depuração está relacionada com a função renal29. Para crianças com comprometimento renal29, as doses de levetiracetam devem ser ajustadas com base na função renal29, uma vez que sua depuração está relacionada com a função renal29. Esta recomendação é baseada em um estudo com pacientes adultos com comprometimento renal29.
Consultar as tabelas a seguir e ajustar a dose conforme indicado. Para usar as tabelas de doseamento, uma estimativa da depuração da creatinina30 em pacientes (CLcr) em mL/min/1,73 m2 é necessária.
Para adultos e adolescentes com peso igual ou superior a 50 kg, o CLcr em mL/min pode ser calculado a partir da determinação da creatinina30 sérica (mg/dL73) usando a fórmula seguinte:
CLcr (mL/min) = {[(140 - idade em anos) × peso em kg] ÷ 72 creatinina30 sérica (mg/dL73)} × 0,85 para mulheres
A CLcr é então ajustada em função da superfície corporal (SP) de acordo com a fórmula:
CLcr (mL/min/1,73 m2) = [CLcr(mL/min) ÷ SP paciente (m2)] × 1,73
Para adolescentes mais novos, crianças e bebês71, utilizando a seguinte fórmula (fórmula de Schwartz):
CLcr = [Altura (cm) × ks] Creatinina30 sérica (mg/dL73)
ks = 0,45 para recém-nascidos de termo e bebês71 até 1 ano de idade; ks = 0,55 para crianças com menos de 13 anos de idade e adolescentes do sexo feminino; ks = 0,7 para adolescentes do sexo masculino.
Ajuste de dose em pacientes adultos e adolescentes com peso superior a 50 kg e comprometimento da função renal29:
| Grupo | Depuração de creatinina30 (mL/min/1,73 m2) |
Dosagem e frequência |
|---|---|---|
|
Normal |
≥ 80 |
500 a 1500 mg/ duas vezes ao dia |
|
Leve |
50–79 |
500 a 1000 mg/ duas vezes ao dia |
|
Moderado |
30–49 |
250 a 750 mg/ duas vezes ao dia |
|
Grave |
< 30 |
250 a 500 mg/ duas vezes ao dia |
|
Paciente em fase terminal de doença renal29 sujeitos à diálise31(1) |
- |
500 a 1000 mg uma vez ao dia(2) |
(1) É recomendada uma dose de ataque de 750 mg no primeiro dia de tratamento com levetiracetam.
(2) Após a diálise31, é recomendada uma dose suplementar de 250 a 500 mg
Ajuste de dose para crianças e adolescentes, a partir de 6 anos, com peso inferior a 50 kg e comprometimento da função renal29:
|
Grupo |
Depuração de creatinina30 |
Dosagem e frequência(1) |
|---|---|---|
| Crianças e adolescentes com peso inferior a 50 kg | ||
|
Normal |
≥ 80 |
10 a 30 mg/kg (0,10 a 0,30 mL/kg) duas vezes ao dia |
|
Leve |
50–79 |
10 a 20 mg/kg (0,10 a 0,20 mL/kg) duas vezes ao dia |
|
Moderado |
30–49 |
5 a 15 mg/kg (0,05 a 0,15 mL/kg) duas vezes ao dia |
|
Grave |
< 30 |
5 a 10 mg/kg (0,05 a 0,10 mL/kg) duas vezes ao dia |
|
Paciente em fase terminal de doença renal29 sujeitos à diálise31 |
-- |
10 a 20 mg/kg (0,10 a 0,20 mL/kg) duas vezes ao dia(2),(3) |
(1) Levetiracetam solução oral deve ser usada para doses inferiores a 250 mg e para pacientes13 incapazes de deglutir72 comprimidos.
(2) É recomendada uma dose de ataque de 15 mg/kg (0,15 mL/kg) no primeiro dia de tratamento de levetiracetam.
(3) É recomendada uma dose suplementar de 5 a 10 mg/kg (0,05 a 0,10 mL/kg) posteriormente à diálise31.
Pacientes com comprometimento hepático: Não é necessário qualquer ajuste da dose em pacientes com comprometimento hepático leve a moderado. Em pacientes com comprometimento hepático grave, a depuração de creatinina30 poderá subestimar o comprometimento renal29. Portanto, é recomendada uma redução de 50% da dose diária de manutenção, quando a depuração de creatinina30 for < 60 mL/min/1,73 m2.
Descontinuação do tratamento
No caso de interrupção do tratamento, tal como para outros medicamentos antiepilépticos, Iludral® (levetiracetam) deverá ser descontinuado gradualmente (vide Advertências e Precauções).
O medicamento pode ser partido para facilitar a deglutição74, mas não para a divisão de doses.
REAÇÕES ADVERSAS
Estudos clínicos
O levetiracetam foi administrado em mais de 3000 indivíduos e pacientes. Mil e vinte e três (1023) pacientes com epilepsia3 participaram dos estudos clínicos controlados. Dados combinados de segurança desses estudos conduzidos em pacientes adultos mostraram que 46,4% e 42,2% dos pacientes tiveram reações adversas nos grupos levetiracetam e placebo8, respectivamente, e que 2,4% e 2% dos pacientes experimentaram reações adversas sérias nos grupos levetiracetam e placebo8, respectivamente.
As reações adversas mais comumente reportadas foram sonolência, astenia75 e tontura76. Na análise combinada de segurança não houve evidência da relação dose-resposta, mas a incidência11 e severidade de reações adversas relacionadas ao Sistema Nervoso Central55 diminuíram com o tempo.
Na monoterapia, 49,8% dos pacientes apresentaram pelo menos uma reação adversa. As reações adversas mais frequentemente relatadas foram fadiga77 e sonolência.
Um estudo conduzido em pacientes pediátricos (4 a 16 anos) mostrou que 55,4% dos pacientes do grupo levetiracetam e 40,2% dos pacientes do grupo placebo8 relataram reações adversas. Reações adversas sérias foram relatadas por 0,0% dos pacientes do grupo levetiracetam e 1% dos pacientes do grupo placebo8.
Os eventos adversos mais comumente reportados foram sonolência, hostilidade, nervosismo, instabilidade emocional, agitação, anorexia78, astenia75 e dor de cabeça79 na população pediátrica. Os resultados de segurança em pacientes pediátricos foram consistentes com o perfil de segurança de levetiracetam em adultos, exceto pelas reações adversas de comportamento e psiquiátricas, que foram mais comuns em crianças do que em adultos (38,6% versus 18,6%). Entretanto, o risco relativo foi similar em crianças se comparado aos adultos.
Um estudo de segurança pediátrico duplo cego, placebo8 controlado com um desenho de não-inferioridade avaliou os efeitos cognitivos80 e neuropsicológicos de levetiracetam em crianças de 4 a 16 anos de idade com crises focais/parciais. Concluiu-se que levetiracetam não foi diferente (não inferior) do placebo8 considerando-se a alteração em relação ao basal na pontuação do teste Leiter-R Atenção e Memória (Memory Screen Composite) na população por-protocolo. Os resultados relacionados ao funcionamento comportamental e emocional indicaram uma piora nos pacientes tratados com levetiracetam no comportamento agressivo, como mensurado de forma padronizada e sistemática, utilizando um instrumento validado (CBCL – Achenback Child Behavior Checklist). Os pacientes, no entanto, que receberam levetiracetam no estudo aberto de acompanhamento de longo prazo não apresentaram piora no funcionamento comportamental e emocional.
Um estudo conduzido em adultos e adolescentes com crises mioclônicas4 (12 a 65 anos) mostrou que 33,3% dos pacientes do grupo levetiracetam e 30% dos pacientes no grupo placebo8 relataram reações adversas. As reações adversas mais comumente relatadas foram dor de cabeça79 e sonolência. A incidência11 de reações adversas em pacientes com crises mioclônicas4 foi mais baixa do que em pacientes adultos com crises focais/parciais (33,3% versus 46,4%).
Um estudo conduzido em adultos e crianças (4 a 65 anos) com epilepsia3 idiopática6 generalizada com crises tônico-clônicas primárias generalizadas mostrou que 39,2% dos pacientes do grupo levetiracetam e 29,8% dos pacientes do grupo placebo8 relataram reações adversas. A reação adversa mais comumente relatada foi fadiga77.
A incidência11 de reações adversas relatadas dos estudos clínicos foi
Reação muito comum (> 1/10):
- Distúrbios do Sistema Nervoso81: sonolência e dor de cabeça79.
- Infecções39 e infestações: nasofaringite.
Reação comum (> 1/100 e < 1/10):
- Distúrbios gastrointestinais: dor abdominal, diarreia82, dispepsia83, náusea84, vômito85.
- Distúrbios do Sistema Nervoso81: crise convulsiva, distúrbio de equilíbrio, tontura76, tremor.
- Distúrbios psiquiátricos: agressividade, depressão, hostilidade, insônia, irritabilidade, nervosismo.
- Distúrbios do metabolismo86 e nutrição87: anorexia78.
O risco de anorexia78 é maior quando topiramato é coadministrado com levetiracetam. - Distúrbios do ouvido e do labirinto88: vertigem89.
- Distúrbios respiratórios, torácicos e do mediastino90: tosse.
- Distúrbios da pele e tecido subcutâneo91: rash92.
Reação incomum (≥ 1/1000 a < 1/100)
- Distúrbios do sangue93 e do sistema linfático94: trombocitopenia35.
- Distúrbios do metabolismo86 e nutrição87: aumento de peso.
- Distúrbios psiquiátricos: instabilidade emocional/mudança de humor, agitação.
- Distúrbios do Sistema Nervoso81: amnésia95, coordenação anormal/ataxia96 cerebelar, distúrbio de atenção, prejuízo de memória.
- Distúrbios oculares: diplopia97, visão98 borrada.
- Distúrbios da pele e tecido subcutâneo91: eczema99, prurido100.
- Distúrbios musculoesqueléticos e do tecido conectivo101: mialgia102.
- Injúria, envenenamento e complicações do procedimento: ferimento.
Reação rara (≥ 1/10000 a < 1/1000)
- Infecções39 e infestações: infecção103.
- Distúrbios psiquiátricos: distúrbios de personalidade, pensamento anormal.
- Distúrbios do Sistema Nervoso81: hipercinesia104.
Experiência pós-comercialização:
Na experiência pós-comercialização, distúrbios psiquiátricos e do Sistema Nervoso81 foram mais frequentemente relatados.
Adicionalmente às reações adversas relatadas durante os estudos clínicos e listadas acima, as seguintes reações adversas foram reportadas na experiência pós-comercialização. Os dados são insuficientes para suportar uma estimativa da incidência11 na população a ser tratada.
- Distúrbios do sangue93 e do sistema linfático94: leucopenia34, neutropenia32, pancitopenia36 (com supressão da medula óssea105 identificada em alguns dos casos) e agranulocitose33.
- Distúrbios cardíacos: prolongamento do intervalo QT no eletrocardiograma106.
- Distúrbios do sistema imune107: reação ao medicamento com eosinofilia108 e sintomas46 sistêmicos109 (DRESS), reações anafiláticas110.
- Distúrbios do metabolismo86 e nutrição87: hiponatremia111.
- Distúrbios psiquiátricos: comportamento anormal, raiva44, delírio112, ataque de pânico, ansiedade, estado de confusão, alucinação113, distúrbios psicóticos, suicídio, tentativa de suicídio e ideação suicida.
- Distúrbios do Sistema Nervoso81: parestesia114, coreoatetose, discinesia, letargia115, distúrbio de marcha, agravamento das crises epilépticas.
- Distúrbios da pele116 e do sistema subcutâneo117: necrólise tóxica epidérmica, síndrome de Stevens-Johnson118, eritema multiforme119, alopecia120 e angioedema121.
- Em vários casos de alopecia120, a recuperação foi observada com a descontinuação do levetiracetam.
- Distúrbios do tecido conectivo101 e musculoesquelético: fraqueza muscular, rabdomiólise122 e aumento da enzima123 creatina-fosfoquinase no sangue93.
- Distúrbios gastrointestinais: pancreatite124.
- Distúrbios hepatobiliares125: hepatite126, insuficiência hepática127.
- Distúrbios do sistema renal29 e urinário: dano renal29 agudo128.
- Investigações: teste anormal da função hepática42, perda de peso.
Descrição das reações adversas selecionadas.
A prevalência129 de rabdomiólise122 e aumento da enzima123 creatina-fosfoquinase no sangue93 é significativamente mais alta em pacientes japoneses em relação aos pacientes não japoneses.
Casos raros de prolongamento do intervalo QT foram observados na vigilância pós-comercialização.
Evidências também sugerem uma possível predisposição da população japonesa à síndrome130 neuroléptica maligna (SNM).
Em casos de eventos adversos, notifique pelo Sistema VigiMed, disponível no Portal da Anvisa.
SUPERDOSE
Sintomas46
Foram observados sonolência, agitação, agressividade, nível de consciência reduzido, depressão respiratória e coma131 com superdoses de Iludral® (levetiracetam).
Tratamento
Após uma superdose aguda, o estômago132 deverá ser esvaziado por lavagem gástrica133 ou indução do vômito85. Não existe antídoto134 específico para levetiracetam. O tratamento de uma superdose deverá ser sintomático135 e pode incluir a hemodiálise136. A eficácia da extração por dialisador é de 60% para o levetiracetam e 74% para o metabólito22 primário.
Em caso de intoxicação ligue para 0800 722 6001, se você precisar de mais orientações.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
SÓ PODE SER VENDIDO COM RETENÇÃO DA RECEITA
MS n°: 1.2214.0113
Farm. Resp.: Marcia da Costa Pereira - CRF-SP n°: 32700
Fabricado por:
Monte Verde S.A.
Departamento de Pocito- Argentina
Importado por:
Adium S.A.
Rodovia Vereador Abel Fabrício Dias, 3400 Água Preta- Pindamonhangaba- SP
CNPJ n° 55.980.684/0001-27
SAC 0800 016 6575