Sandostatin LAR
NOVARTIS BIOCIENCIAS S.A
IDENTIFICAÇÃO DO MEDICAMENTO
Sandostatin LAR®
acetato de octreotida
Pó para Suspensão Injetável 10 mg; 20 mg e 30 mg
FORMA FARMACÊUTICA E APRESENTAÇÃO:
Pó para Suspensão Injetável
Embalagens contendo 1 frasco-ampola de pó para suspensão injetável + 1 seringa1 preenchida com 2,0 mL de diluente + 1 sistema de aplicação contendo 1 agulha estéril com protetor de segurança e 1 adaptador de frasco.
VIA INTRAMUSCULAR
USO ADULTO
COMPOSIÇÃO:
Cada frasco-ampola de Sandostatin LAR® 10 mg contém:
| octreotida (equivalente a 11,20 mg de acetato de octreotida) | 10 mg |
| excipiente q.s.p. | 1 frasco-ampola |
Excipientes: poli (DL-lactídeo-co-glicolídio), manitol estéril.
Diluente: Cada seringa1 preenchida contém carmelose sódica, manitol, poloxâmer e água para injetáveis.
Cada frasco-ampola de Sandostatin Lar® 20 mg contém
| octreotida (equivalente a 22,40 mg de acetato de octreotida) | 20 mg |
| excipiente q.s.p. | 1 frasco-ampola |
Excipientes: poli (DL-lactídeo-co-glicolídio), manitol estéril.
Diluente: Cada seringa1 preenchida contém carmelose sódica, manitol, poloxâmer e água para injetáveis.
Cada frasco-ampola de Sandostatin Lar® 30 mg contém:
| octreotida (equivalente a 33,60 mg de acetato de octreotida) | 30 mg |
| excipiente q.s.p. | 1 frasco-ampola |
Excipientes: poli (DL-lactídeo-co-glicolídio), manitol estéril.
Diluente: Cada seringa1 preenchida contém carmelose sódica, manitol, poloxâmer e água para injetáveis.
INFORMAÇÕES AO PACIENTE
PARA QUE ESTE MEDICAMENTO É INDICADO?
Sandostatin Lar® é usado para:
- Tratamento de acromegalia2;
- Alívio de sintomas3 associados com a superprodução de alguns hormônios específicos e outras substâncias relacionadas pelo estômago4, intestino ou pâncreas5;
- Tratamento de tumores neuroendócrinos localizados no intestino (por exemplo: apêndice6, intestino delgado7 ou cólon8).
Acromegalia2 é uma condição na qual o corpo produz muito hormônio9 do crescimento. Normalmente, o hormônio9 do crescimento controla o crescimento dos tecidos, órgãos e ossos. O excesso de hormônio9 do crescimento leva a um aumento no tamanho dos ossos e tecidos, especialmente das mãos10 e pés. Na maioria dos casos, a superprodução do hormônio9 do crescimento é provocada por um aumento na glândula11 pituitária (um adenoma12 pituitário benigno). Ao reduzir os níveis sanguíneos de hormônio9 de crescimento, Sandostatin Lar® evidentemente reduz os sintomas3 da acromegalia2, que incluem dor de cabeça13, transpiração14 excessiva, dormência15 das mãos10 e pés, cansaço e dor nas juntas. O tratamento com
Sandostatin Lar® pode reduzir o tamanho do adenoma12.
Sandostatin Lar® é usado para o tratamento de pacientes com acromegalia2:
A superprodução de hormônios específicos e outras substâncias naturais relacionadas pode ser provocada por algumas condições raras do estômago4, intestino ou pâncreas5. Isto afeta o equilíbrio hormonal natural do corpo e resulta em uma variedade de sintomas3, tais como vermelhidão, diarreia16, pressão arterial17 baixa, erupção18 cutânea19 e perda de peso. O tratamento com Sandostatin Lar® ajuda a controlar estes sintomas3. É geralmente administrado em pacientes que já responderam bem ao tratamento com Sandostatin subcutâneo20.
Tumores neuroendócrinos são tumores raros que podem ser encontrados em diferentes partes do corpo. Sandostatin Lar® é também usado no controle do crescimento destes tumores, quando estão localizados no intestino (por exemplo, apêndice6, intestino delgado7 ou cólon8).
- Quando o tratamento com a outra forma do Sandostatin®, administrada todos os dias por meio de uma injeção21 por via subcutânea22, tiver demonstrado resultado satisfatório, a troca para o Sandostatin Lar® significa que as injeções serão muito menos frequentes;
- Quando outros tipos de tratamento para acromegalia2 (cirurgia ou radioterapia23) forem inadequados ou ineficazes;
- Após a radioterapia23 para cobrir o período até a radioterapia23 começar a fazer efeito completamente.
COMO ESTE MEDICAMENTO FUNCIONA?
Sandostatin Lar® é um composto derivado sintético da somatostatina. A somatostatina é normalmente encontrada no corpo humano24, onde ela inibe a liberação de certos hormônios, como o hormônio9 de crescimento. As vantagens de Sandostatin Lar® sobre a somatostatina são a sua maior potência e seu efeito mais duradouro.
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
Se você for hipersensível (alérgico) à octreotida ou a qualquer componente da formulação de Sandostatin Lar®.
O QUE DEVO SABER ANTES DE USAR ESTE MEDICAMENTO?
Siga cuidadosamente todas as instruções dadas pelo seu médico. Elas podem diferir das informações contidas nesta bula. Leia todas as seguintes explicações antes de usar Sandostatin Lar®.
Advertências e precauções
- Pacientes tratados com Sandostatin Lar® devem ser controlados, pois pode ocorrer uma expansão dos tumores secretores de hormônio9 de crescimento;
- Se você tem cálculos biliares, ou já teve no passado, informe ao seu médico, já que o uso prolongado de Sandostatin Lar® pode resultar na formação de cálculos biliares. Seu médico pode querer verificar sua vesícula biliar25 periodicamente;
- Se você tem histórico de privação de vitamina26 B12 , seu médico pode querer verificar o seu nível de vitamina26 B12 periodicamente;
- Se você está sob tratamento prolongado com Sandostatin Lar®, seu médico pode querer verificar periodicamente a função da sua tireoide27.
- Informe seu médico se você tem diabetes28, pois Sandostatin Lar® pode afetar os níveis de açúcar29 no sangue30. Se você é diabético, seus níveis de açúcar29 devem ser verificados regularmente;
- Informe ao seu médico se estiver tomando medicamentos para controlar a pressão arterial17 (betabloqueadores ou bloqueadores de canais de cálcio) ou agentes que controlam o equilíbrio hídrico e eletrolítico. Ajustes de dose podem ser necessários.
Populações especiais
Crianças e adolescentes (abaixo de 18 anos): Existe pouca experiência com o uso de Sandostatin Lar® em crianças.
Idosos (com 65 anos ou mais): A experiência com Sandostatin Lar® tem mostrado que não há requisitos especiais para pacientes31 de 65 anos ou mais.
Gravidez32 e Lactação33
Sandostatin Lar® só deve ser utilizado durante a gravidez32 se necessário.
Informe ao seu médico se estiver grávida, ou pretende engravidar.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Mulheres em idade fértil: Mulheres em idade fértil devem usar um método contraceptivo eficaz durante o tratamento.
Amamentação34: Não se sabe se Sandostatin Lar® passa para o leite materno. Não existe experiência com Sandostatin Lar® em mulheres amamentando. Você não deve amamentar seu filho enquanto estiver usando Sandostatin Lar®.
Interações medicamentosas
Informe ao seu médico ou farmacêutico se estiver tomando, ou tenha tomado recentemente qualquer medicamento. Isto
inclui qualquer medicamento que você tenha comprado sem receita médica. Geralmente você pode continuar tomando outros medicamentos enquanto usa Sandostatin Lar®. No entanto, certos medicamentos, como a cimetidina, ciclosporina, bromocriptina, quinidina e terfenadina podem ser afetados por Sandostatin Lar®. Se você é diabético, informe ao seu médico, pois seu tratamento antidiabético pode sofrer ajuste de dose.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento. Não use este medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde35.
ONDE, COMO E POR QUANTO TEMPO POSSO GUARDAR ESTE MEDICAMENTO?
Cuidados de conservação
O produto deve ser protegido da luz e conservado sob refrigeração (entre 2 e 8°C). Sandostatin Lar® deve ser conservado abaixo de 25°C apenas no dia da injeção21. A suspensão deverá ser preparada imediatamente antes da injeção intramuscular36.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características físicas e organolépticas do produto
Frasco-ampola contendo pó de coloração branca a esbranquiçada e seringa1 preenchida contendo solução límpida e incolor, como diluente. Após a reconstituição, a suspensão apresenta aspecto uniforme.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
COMO DEVO USAR ESTE MEDICAMENTO?
Sandostatin Lar® sempre deve ser administrado como uma injeção21 no músculo das nádegas37. Com a administração repetida, a nádega esquerda e direita devem ser utilizadas alternadamente.
Instruções para a administração de Sandostatin Lar®, assim como sua aplicação intramuscular, são fornecidas no final desta bula.
A dose inicial é normalmente de 20 mg de Sandostatin Lar®, que é dada em intervalos de 4 semanas. Após os 3 primeiros meses de tratamento com Sandostatin Lar®, seu médico provavelmente vai querer reavaliar o seu tratamento. Isto pode envolver a medida dos níveis de hormônio9 de crescimento ou outros hormônios no sangue30. Dependendo destes resultados, e de como você estiver se sentindo, a dose de Sandostatin Lar® pode necessitar de alteração. A dose administrada em cada injeção21 pode ser reduzida para 10 mg, ou, se o tratamento não for totalmente eficaz, pode ser aumentada para 30 mg. Depois que a dose mais adequada para você tenha sido encontrada, seu médico provavelmente vai solicitar uma reavaliação do seu tratamento a cada 6 meses.
Se você receber Sandostatin Lar® para o tratamento de tumores neuroendócrinos localizados no intestino, a dose habitual é de 30 mg, com intervalos de 4 semanas. O seu médico decidirá durante quanto tempo deve ser tratado com Sandostatin Lar®.
Se você estava previamente sendo tratado com Sandostatin® por via subcutânea22, você pode iniciar o tratamento com Sandostatin Lar® no dia após a última dose de Sandostatin® por via subcutânea22. Se você não foi tratado previamente com Sandostatin® por via subcutânea22, então você pode começar com um curto período de tratamento por via subcutânea22 para avaliar como você responde, antes de mudar para Sandostatin Lar®.
Entretanto, dependendo do problema específico para o qual Sandostatin Lar® está sendo administrado, pode ser necessário que você continue usando Sandostatin® por via subcutânea22 durante cerca de 2 semanas após a primeira injeção21 de Sandostatin Lar®.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
O QUE DEVO FAZER QUANDO EU ME ESQUECER DE USAR ESTE MEDICAMENTO?
Se esquecer de administrar a injeção21, administre uma dose logo que se lembrar e continue como de costume. Não haverá mal nenhum se você atrasar uma dose por poucos dias, mas alguns sintomas3 temporários poderão reaparecer até que você retome os intervalos regularmente.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
QUAIS OS MALES QUE ESTE MEDICAMENTO PODE ME CAUSAR?
Como com todos os medicamentos, pacientes tratados com Sandostatin Lar® podem experimentar reações adversas,
embora nem todos os pacientes possam manifestá-las. Se você apresentar qualquer uma destas reações, informe ao seu médico.
Algumas reações adversas podem ser graves e podem precisar de cuidados médicos imediatos
Algumas são muito comuns (ocorre em mais de 10% dos pacientes que utilizam este medicamento):
- Cálculos biliares, levando ao aparecimento súbito de dor nas costas38;
- Aumento do açúcar29 no sangue30.
Algumas são comuns (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
- Diminuição da atividade da tireoide27 (hipotireoidismo39), provocando alterações no ritmo cardíaco, no apetite ou no peso, cansaço, sensação de frio, ou inchaço40 na parte frontal do pescoço41;
- Alterações nos testes da função da tireoide27;
- Inflamação42 da vesícula biliar25 (colecistite43);
- Grande redução do açúcar29 no sangue30;
- Tolerância à glicose44 prejudicada;
- Batimento cardíaco lento.
Algumas são incomuns (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento):
- Sede, baixa produção de urina45, urina45 escura, pele46 seca e corada;
- Batimento cardíaco rápido.
Outras reações adversas graves
Se você tiver qualquer um destes, informe ao seu médico imediatamente:
- Hipersensibilidade (alergia47), incluindo vermelhidão cutânea19;
- Um tipo de reação alérgica48 (anafilaxia49), que pode causar dificuldade de deglutição50 ou respiração, inchaço40 e formigamento, possivelmente com queda de pressão arterial17, tontura51 ou perda de consciência;
- Inflamação42 do pâncreas5 (pancreatite52);
- Inflamação42 do fígado53 (hepatite54), os sintomas3 podem incluir amarelamento da pele46 e dos olhos55 (icterícia56), náuseas57, vômitos58, perda de apetite, sensação geral de mal-estar, coceira, urina45 de cor escura;
- Batimento cardíaco irregular;
- Baixo nível de contagem de plaquetas59 no sangue30; isto pode resultar em hemorragias60 ou hematomas61.
Outros efeitos colaterais62
Os efeitos secundários listados abaixo são geralmente leves e tendem a desaparecer no decorrer do tratamento:
Alguns são muito comuns (ocorre em mais de 10% dos pacientes que utilizam este medicamento):
- Diarreia16;
- Dor abdominal;
- Náuseas57;
- Constipação63;
- Flatulência;
- Dor de cabeça13;
- Dor no local da injeção21.
Alguns são comuns (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento):
- Desconforto gástrico após a refeição (dispepsia64);
- Vômitos58;
- Sensação de saciedade no estômago4;
- Fezes gordurosas;
- Perda de fezes;
- Descoloração das fezes;
- Tonturas65;
- Perda de apetite;
- Alteração nos testes da função hepática66;
- Perda de cabelo67;
- Falta de ar;
- Fraqueza.
Se você apresentar qualquer outra reação adversa não mencionada na bula, informe ao seu médico ou farmacêutico.
Atenção: este produto é medicamento que possui nova indicação terapêutica68 no país e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis, mesmo que indicado e utilizado corretamente, podem ocorrer eventos adversos imprevisíveis ou desconhecidos. Nesse caso, informe seu médico.
O QUE FAZER SE ALGUÉM USAR UMA QUANTIDADE MAIOR DO QUE A INDICADA DESTE MEDICAMENTO?
Nenhuma reação com risco de vida foi relatada após uma superdose de Sandostatin Lar®.
Os sintomas3 de superdose: calor, micção69 frequente, cansaço, depressão, ansiedade e falta de concentração.
Se você acha que ocorreu uma superdose e sentir estes sintomas3, procure seu médico.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Instruções de uso para o profissional de saúde35.
Instruções para injeção intramuscular36 de Sandostatin Lar®.
SOMENTE PARA INJEÇÃO21 NA REGIÃO INTRAGLUTEAL PROFUNDA
Siga as instruções abaixo cuidadosamente para assegurar a saturação completa do pó e sua suspensão uniforme antes da injeção intramuscular36.
A suspensão de Sandostatin Lar® deve ser preparada apenas imediatamente antes da administração. Sandostatin Lar® deve ser administrado apenas por profissionais da saúde35 treinados.
Conteúdo:
Sistema de aplicação contendo 1 frasco-ampola + seringa1 preenchida de 2,0 mL de diluente + 1 agulha estéril com protetor de segurança e adaptador de frasco.
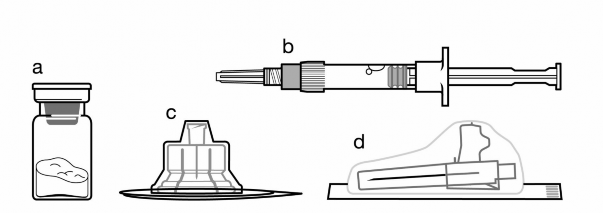
- Um frasco contendo Sandostatin Lar® pó;
- Uma seringa1 preenchida com diluente;
- Um adaptador de frasco para reconstituição do produto;
- Uma agulha com protetor de segurança.
Antes da injeção21 intraguteal profunda, siga cuidadosamente as instruções, a seguir, para assegurar reconstituição apropriada de Sandostatin Lar®.
Há 3 ações críticas na reconstituição de Sandostatin Lar®. Deixar de segui-los poderá resultar na falha da entrega do fármaco70 apropriadamente.
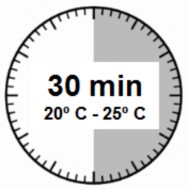
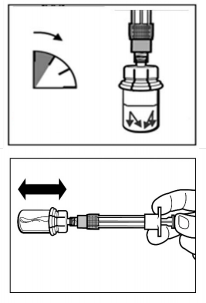
- O kit de injeção21 deve atingir a temperatura ambiente. Remover o kit de injeção21 da refrigeração e manter em temperatura ambiente por pelo menos 30 minutos antes da reconstituição, mas não ultrapassar 24 horas.
- Depois de adicionar a solução diluente, assegurar que o pó está completamente saturado, mantendo o frasco em descanso durante 5 minutos.
- Após a saturação, agitar o frasco moderadamente no sentido horizontal por no mínimo 30 segundos até obter uma suspensão uniforme. A suspensão de Sandostatin Lar® só deve ser preparada imediatamente antes da administração. Sandostatin Lar® só deve ser administrado por profissional da saúde35 treinado.
Passo 1
Retire da refrigeração o kit de injeção21 de Sandostatin Lar®.
ATENÇÃO: é necessário que seja iniciado o processo de reconstituição somente após o kit de injeção21 atingir a temperatura ambiente. Deixe o kit atingir a temperatura ambiente por no mínimo 30 minutos antes da reconstituição, mas não ultrapassar 24 horas.
Observação: o kit de injeção21 pode ser refrigerado novamente, caso necessário.
Passo 2
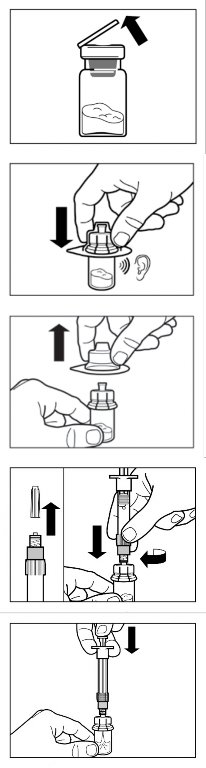
Remova a tampa plástica do frasco e limpe a borracha do frasco com um pedaço de algodão embebido em álcool.
Remova o filme do suporte contendo o adaptador de frasco. NÃO retire o adaptador do suporte.
Segurando o suporte, posicione o adaptador no topo do frasco e empurre-o totalmente para baixo para que ele se encaixe no frasco, confirmado por um “clique” audível.
Segure o suporte pelo topo e com um movimento vertical retire o suporte do adaptador de frasco.
Passo 3
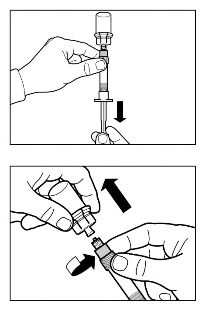
Retire a tampa da seringa1 preenchida contendo o diluente e ajuste a seringa1 no adaptador de frasco.
Empurre lentamente o êmbolo71 até o fim para transferir todo o diluente para dentro do frasco.
Passo 4
ATENÇÃO: é necessário deixar o frasco em descanso por 5 minutos para assegurar que o diluente tenha saturado completamente o pó.
Obs. É normal se o êmbolo71 se mover para cima, pois pode haver uma ligeira sobrepressão no frasco.
Neste momento, prepare o paciente para a aplicação.
Passo 5
Após o período de umidificação, certifique-se de que o êmbolo71 tenha sido empurrado totalmente através da seringa1. ATENÇÃO: mantenha o êmbolo71 pressionado e agite o frasco moderadamente na direção horizontal por pelo menos 30 segundos. Verifique visualmente se o pó está complemente suspenso no diluente (suspensão leitosa uniforme). Repita a agitação moderada por mais 30 segundos se o pó não estiver completamente suspenso.
Passo 6
Faça a desinfecção72 do local da injeção21 com um algodão embebido em álcool.
Vire a seringa1 e o frasco verticalmente, puxe o êmbolo71 vagarosamente e retire todo o conteúdo do frasco para dentro da seringa1.
Retire a seringa1 do adaptador do frasco.
Passo 7
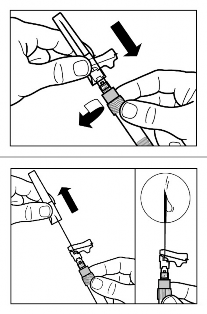
Encaixe a agulha com protetor de segurança na seringa1. Gentilmente agite novamente a seringa1 para assegurar uma suspensão leitosa uniforme.
Retire a tampa de proteção da agulha em linha reta.
Bata suavemente na seringa1 para remover bolhas visíveis e expulsá-las da seringa1. Verifique se o local da injeção21 não foi contaminado.
Prossiga imediatamente ao Passo 8 para administração ao paciente. Qualquer atraso pode resultar em sedimentação.
Passo 8
O Sandostatin Lar® deve ser administrado apenas na região glútea73 profunda. NUNCA por via intravenosa.
Insira a agulha completamente no lado direito ou esquerdo do glúteo em um ângulo de 90º da pele46.
Aspire lentamente para verificar se algum vaso sanguíneo não foi atingido, caso tenha sido mude a posição da agulha. Aplicando uma pressão contínua no êmbolo71 até que a seringa1 esvazie. Retire a agulha e ative a proteção de segurança conforme figura do Passo 9.
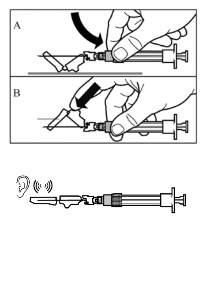
Passo 9
Ative a proteção de segurança sobre a agulha utilizando técnica de mão74 única:
- pressionando a parte articulada da proteção de segurança sobre uma superfície rígida, p.ex. uma mesa (Figura A).
- ou empurrando para frente a parte articulada com o dedo indicador, mantendo sempre todos os dedos atrás da ponta da agulha (Figura B).
Um “clique” audível confirma a ativação apropriada do mecanismo de segurança.
Descarte imediatamente o frasco e a seringa1 com a agulha em um recipiente para perfurocortantes ou outro recipiente fechado rígido.
Locais de injeção21
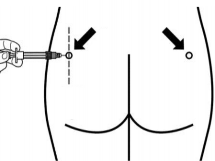
(ângulo 90°)
Sandostatin Lar® deve ser administrado somente por injeção intramuscular36 na região glútea73, nunca por via intravenosa. Se um vaso sanguíneo for atingido, insira uma nova agulha e selecione um outro local de injeção21.
DIZERES LEGAIS
VENDA SOB PRESCRIÇÃO MÉDICA
MS – 1.0068.0009
Farm. Resp.: Flavia Regina Pegorer – CRF-SP 18.150
Importado por:
Novartis Biociências S.A. Av. Prof. Vicente Rao, 90
São Paulo - SP
CNPJ: 56.994.502/0001-30
Indústria Brasileira
Fabricado por:
Sandoz GmbH, Langkampfen, Áustria
SAC 0800 888 3003