
INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE AVASTIN
1. CARACTERÍSTICAS FARMACOLÓGICAS
Descrição
Avastin® é o nome comercial de bevacizumabe, um anticorpo1 monoclonal humanizado recombinante, produzido por tecnologia de DNA recombinante em um sistema de expressão de célula2 de mamífero de ovário3 de hamster chinês, em um meio nutriente que contém o antibiótico gentamicina e é purificado por um processo que inclui inativação viral específica e etapas de remoção. Gentamicina é detectável no produto final em ≤ 0,35 ppm. O bevacizumabe é constituído de 214 aminoácidos e tem um peso molecular de aproximadamente 149.000 dáltons.
Farmacodinâmica
Mecanismo de ação: Avastin® é um anticorpo1 monoclonal humanizado recombinante que se liga e neutraliza seletivamente a atividade biológica do fator de crescimento do endotélio vascular4 humano (VEGF). O bevacizumabe contém regiões estruturais humanas, com regiões ligantes de antígenos5 de um anticorpo1 murino humanizado, que se liga ao VEGF. Avastin® inibe a ligação de VEGF aos seus receptores, Flt-1 e KDR, na superfície das células6 endoteliais. A neutralização da atividade biológica do VEGF reduz a vascularização de tumores, inibindo, assim, o crescimento tumoral. A administração de bevacizumabe ou de seu anticorpo1 murino original a modelos de xenoenxerto de câncer7 em camundongos resultou em atividade antitumoral extensa em cânceres humanos, incluindo câncer7 de cólon8, mama9, pâncreas10 e próstata11. A progressão da doença metastática12 foi inibida, e a permeabilidade13 microvascular foi reduzida.
Dados de segurança pré-clínicos
Desenvolvimento epifisário: em estudos com até 26 semanas de duração em macacos cynomolgus, Avastin® esteve associado à displasia14 epifisária15, caracterizada principalmente por espessamento da cartilagem16 da placa17 de crescimento, formação de placa17 óssea subcondral18 e inibição de invasão vascular19 da placa17 de crescimento. Esse efeito ocorreu em doses ≥ 0,8 vez a dose terapêutica20 humana e níveis de exposição discretamente abaixo da exposição clínica humana esperada, com base em concentrações séricas médias. Deve-se notar, no entanto, que a displasia14 epifisária15 ocorreu apenas em animais em crescimento ativo, com placas21 de crescimento abertas. Como Avastin® será mais provavelmente administrado a pacientes adultos com placas21 de crescimento fechadas, não se espera que a displasia14 epifisária15 ocorra nessa população.
Cicatrização de feridas: os efeitos de bevacizumabe sobre cicatrização de feridas circulares foram estudados em coelhos. A reepitelização de feridas foi retardada em coelhos após cinco doses de bevacizumabe de 2 a 50 mg/kg, durante duas semanas. Foi observada tendência à relação com a dose. A magnitude do efeito sobre a cicatrização de feridas foi semelhante à observada com a administração de corticosteroides. Ao cessar o tratamento com 2 ou 10 mg/kg de bevacizumabe, as feridas se fecharam completamente. A menor dose, 2 mg/kg, foi aproximadamente equivalente à dose terapêutica20 proposta. Um modelo mais sensível, de cicatrização de ferida linear, também foi estudado em coelhos. A administração de três doses de bevacizumabe, variando de 0,5 a 2 mg/kg, reduziu, de forma dose dependente, a tensão da ferida, o que foi compatível com o retardo da cicatrização da ferida. A menor dose, 0,5 mg/kg, foi cinco vezes menor que a dose terapêutica20 proposta.
Como foram observados efeitos sobre cicatrização de feridas em coelhos, com doses abaixo da dose terapêutica20 proposta, a capacidade de bevacizumabe exercer impacto adverso sobre cicatrização de feridas no homem deve ser considerada.
Em macacos cynomolgus, os efeitos de bevacizumabe sobre a cicatrização de incisão22 linear foram altamente variáveis, e uma relação entre a dose e a resposta não ficou evidente.
Função renal23: em macacos cynomolgus normais, bevacizumabe não apresentou nenhum efeito mensurável sobre a função renal23, quando administrado uma ou duas vezes por semana, durante até 26 semanas, e não se acumulou no rim24 de coelhos, depois de duas doses de até 100 mg/kg (aproximadamente 80 vezes maior que a dose terapêutica20 proposta).
Estudos de pesquisa de toxicidade25 em coelhos que usaram os modelos de disfunção renal23 mostraram que bevacizumabe não exacerbou a lesão26 glomerular renal23 induzida por albumina27 de soro28 bovino ou a lesão26 tubular renal23 induzida por cisplatina.
Albumina27: em macacos cynomolgus machos, bevacizumabe administrado em doses de 10 mg/kg, duas vezes por semana, ou 50 mg/kg, uma vez por semana, durante 26 semanas, foi associado com redução estatisticamente significativa da albumina27, da razão entre albumina27 e globulina29 e aumento da globulina29.
Esses efeitos foram reversíveis com a interrupção da exposição. Como os parâmetros permaneceram dentro do intervalo de referência normal de valores para esses desfechos, essas alterações não foram consideradas clinicamente significativas.
Hipertensão30: em doses de até 50 mg/kg, duas vezes por semana, em macacos cynomolgus, bevacizumabe não apresentou nenhum efeito sobre a pressão arterial31.
Hemostasia32: estudos de toxicologia não clínica, durante até 26 semanas, em macacos cynomolgus não encontraram alterações hematológicas ou nos parâmetros de coagulação33, incluindo número de plaquetas34, tempo de protrombina35 e tromboplastina36 parcial ativada. Um modelo de hemostasia32 em coelhos, usado para pesquisar o efeito de bevacizumabe sobre a formação de trombos37, não demonstrou alteração na velocidade de formação de trombos37 ou nenhum outro parâmetro hematológico em comparação ao tratamento com veículo de bevacizumabe.
Mutagenicidade/carcinogenicidade: não foram realizados estudos para avaliar o potencial carcinogênico e mutagênico de Avastin®.
Toxicidade25 reprodutiva: não foram realizados estudos específicos em animais para avaliar o efeito de Avastin® sobre a fertilidade. Não foi observado nenhum efeito adverso nos órgãos reprodutivos masculinos em estudos de toxicidade25 com doses repetidas em macacos cynomolgus.
A inibição da função ovariana foi caracterizada por reduções no peso ovariano e/ou uterino e no número de corpos lúteos, redução na proliferação endometrial e inibição da maturação folicular em macacos cynomolgus tratados com Avastin® durante 13 ou 26 semanas. As doses associadas com esse efeito foram ≥ 4 vezes a dose terapêutica20 humana ou ≥ 2 vezes acima da exposição humana esperada com base nas concentrações séricas médias em macacos fêmeas.
Em coelhos, a administração de 50 mg/kg de bevacizumabe resultou em redução significativa do peso ovariano e do número de corpos lúteos. Os resultados em macacos e coelhos foram reversíveis com a interrupção do tratamento. É provável que a inibição da angiogênese38 após a administração de bevacizumabe resulte em um efeito adverso sobre a fertilidade feminina.
Teratogenicidade: foi demonstrado que Avastin® é embriotóxico e teratogênico39 quando administrado a coelhos. Os efeitos observados incluíram reduções de peso materno e fetal, número aumentado de reabsorções fetais e incidência40 aumentada de alterações macroscópicas e esqueléticas fetais específicas. As evoluções fetais adversas foram observadas em todas as doses testadas, de 10 a 100 mg/kg.
Farmacocinética
A farmacocinética de bevacizumabe foi caracterizada em pacientes com diversos tipos de tumores sólidos. As doses testadas foram de 0,1 - 10 mg/kg, a cada semana, em fase I; de 3 - 20 mg/kg, a cada duas ou três semanas, em fase II; 5 mg/kg, a cada duas semanas, ou 15 mg/kg, a cada três semanas, em fase III. Em todos os estudos clínicos, o bevacizumabe foi administrado por infusão intravenosa (IV). Como observado com outros anticorpos41, as propriedades farmacocinéticas de bevacizumabe são bem representadas por um modelo bicompartimental. De modo geral, com base nos estudos clínicos, a distribuição de bevacizumabe foi caracterizada por uma baixa depuração, volume limitado do compartimento central (Vc) e meia-vida de eliminação prolongada.
Isso permite que os níveis séricos terapêuticos desejados de bevacizumabe sejam mantidos com uma variação do esquema de administração (tal como uma administração a cada duas ou três semanas).
Na análise farmacocinética populacional de bevacizumabe, não foi constatada diferença significativa na farmacocinética de bevacizumabe em relação à idade (nenhuma correlação entre a depuração de bevacizumabe e a idade do paciente [a mediana de idade foi de 59 anos, com IC 95, 37 a 76 anos]).
Um grande impacto clínico da doença e hipoalbuminemia42 são geralmente indicativos da gravidade da doença. A depuração de bevacizumabe foi, aproximadamente, 30% maior em pacientes com níveis baixos de albumina27 sérica e 7% maior em pacientes com um maior impacto clínico da doença, em comparação com pacientes com valores medianos de albumina27 e massa tumoral.
Distribuição: o valor do volume do compartimento central (Vc) foi de 2,73 litros e 3,28 litros para mulheres e homens, respectivamente, sendo essa a faixa que tem sido descrita para IgGs e outros anticorpos41 monoclonais. O valor do volume periférico (Vp) foi de 1,69 litro e 2,35 litros para mulheres e homens, respectivamente, quando bevacizumabe é coadministrado com agentes antineoplásicos. Após a correção para o peso corporal, os homens apresentaram Vc maior (+20%) que as mulheres.
Metabolismo43: a avaliação do metabolismo43 de bevacizumabe em coelhos após dose única IV de I125-bevacizumabe indicou que seu perfil metabólico foi semelhante ao esperado para uma molécula de IgG original que não se liga ao VEGF. O metabolismo43 e a eliminação de bevacizumabe são similares ao da IgG endógena, ou seja, ocorrem principalmente por meio do catabolismo44 proteolítico em todo o corpo, inclusive nas células6 endoteliais, e não dependem fundamentalmente da eliminação por meio dos rins45 e fígado46. A ligação da IgG ao receptor FcRn a protege do metabolismo43 celular e resulta na meia-vida terminal longa.
Eliminação: a farmacocinética de bevacizumabe é linear em doses de 1,5 até 10 mg/kg/semana.
O valor para a depuração é, na média, igual a 0,188 L/dia para mulheres e 0,220 L/dia para homens. Após a correção para o peso corporal, os homens apresentavam depuração de bevacizumabe maior (+ 17%) que as mulheres. Conforme o modelo bicompartimental, a meia-vida de eliminação é de 18 dias para um típico paciente feminino e de 20 dias para um típico paciente masculino.
Farmacocinética em populações especiais
As farmacocinéticas populacionais foram analisadas para avaliar os efeitos das características demográficas. Os resultados mostraram não haver diferenças significativas na farmacocinética de bevacizumabe em relação à idade.
Crianças e adolescentes: a farmacocinética de bevacizumabe foi estudada em um número limitado de pacientes pediátricos. Os dados farmacocinéticos resultantes sugerem que o volume de distribuição e a depuração de bevacizumabe foram comparáveis aos de adultos com tumores sólidos.
Pacientes com disfunção renal23: não foram realizados estudos para investigar a farmacocinética de bevacizumabe em pacientes com disfunção renal23, já que os rins45 não são os principais órgãos do metabolismo43 e excreção de bevacizumabe.
Pacientes com disfunção hepática47: não foram realizados estudos para investigar a farmacocinética de bevacizumabe em pacientes com disfunção hepática47, já que o fígado46 não é o principal órgão do metabolismo43 e excreção de bevacizumabe.
2. RESULTADOS DE EFICÁCIA
Câncer7 colorretal metastático (CCRm)
A segurança e a eficácia da dose recomendada de Avastin® (5 mg/kg de peso, a cada duas semanas) em carcinoma48 metastático do cólon8 ou reto49 foram estudadas em três estudos clínicos randomizados, com controle ativo, que avaliaram a combinação de Avastin® com quimioterapia50 à base de fluoropirimidina como primeira linha de câncer7 colorretal metastático.1, 2, 3, 4, 5 Avastin® foi combinado com dois esquemas quimioterápicos:
• Estudo AVF2107g: um esquema semanal de irinotecano/5-fluorouracil e leucovorin em bolus51 (esquema IFL), durante um total de quatro semanas, dentro de cada ciclo de seis semanas.1
• Estudo AVF0780g: em combinação com 5-fluorouracil/leucovorin (5-FU/LV) em bolus51, durante um total de seis semanas, dentro de cada ciclo de oito semanas (esquema Roswell Park).2
• Estudo AVF2192g: em combinação com 5-fluorouracil/leucovorin (5-FU/LV) em bolus51, durante um total de seis semanas, dentro de cada ciclo de oito semanas (esquema Roswell Park), em pacientes que não eram candidatos ideais para tratamento de primeira linha com irinotecano.3
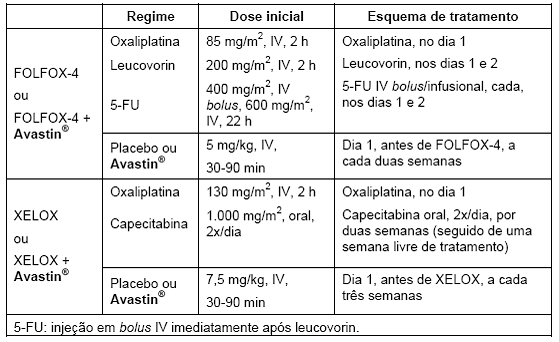
Dois estudos clínicos adicionais foram conduzidos em terapia de primeira linha (NO16966) e segunda linha (E3200), para tratamento de câncer7 colorretal metastático com Avastin®, administrado nos regimes a seguir descritos, em combinação com FOLFOX-4 (5-FU/LV/oxaliplatina) e XELOX (capecitabina/oxaliplatina):
• NO16966: Avastin®, 7,5 mg/kg de peso, a cada três semanas, em combinação com capecitabina oral e oxaliplatina intravenosa (XELOX) ou Avastin®, 5 mg/kg, a cada duas semanas, em combinação com leucovorin e 5-FU em bolus51, seguido de 5-FU infusional com oxaliplatina intravenosa (FOLFOX-4).4
• E3200: Avastin®, 10 mg/kg de peso, a cada duas semanas, em combinação com leucovorin e 5-FU em bolus51, seguido de 5-FU infusional com oxaliplatina intravenosa (FOLFOX-4).5
AVF2107g:
Esse foi um estudo fase III, randomizado52, duplo-cego, com controle ativo, que avaliou Avastin® em combinação com IFL como tratamento de primeira linha para carcinoma48 metastático do cólon8 ou reto49.1 Oitocentos e treze pacientes foram randomizados para receber IFL + placebo53 (Braço 1) ou IFL + Avastin® (5 mg/kg, a cada duas semanas, Braço 2). Um terceiro grupo de 110 pacientes recebeu 5-FU em bolus51/LV + Avastin® (Braço 3). A inclusão no Braço 3 foi interrompida, conforme predeterminado, depois que foi estabelecida e considerada aceitável a segurança de Avastin® combinado ao esquema IFL.
O desfecho primário de eficácia do estudo foi a sobrevida54 global. A adição de Avastin® ao IFL resultou em aumento estatisticamente significativo da sobrevida54 global, sobrevida54 livre de progressão (SLP) e taxa de resposta global (Tabela 1). O benefício clínico de Avastin®, medido pela sobrevida54, foi observado em todos os subgrupos predeterminados de pacientes, incluindo os definidos por idade, sexo, estado de desempenho (performance status), localização do tumor55 primário, número de órgãos envolvidos e duração da doença metastática12.
Os resultados de eficácia de Avastin® em combinação com quimioterapia50 IFL são mostrados na Tabela 1.

Antes da descontinuação do Braço 3 (5-FU/LV + Avastin®), entre os 110 pacientes randomizados, a mediana de sobrevida54 global foi de 18,3 meses, e a de sobrevida54 livre de progressão foi de 8,8 meses.
AVF2192g:
Esse foi um estudo clínico fase II, randomizado52, duplo-cego, com controle ativo, que estudou os efeitos de Avastin® em combinação com 5-FU/leucovorin como tratamento de primeira linha para câncer7 colorretal metastático em pacientes que não eram candidatos ideais para tratamento de primeira linha com irinotecano. Cento e cinco pacientes foram randomizados para 5-FU/LV + placebo53, e 104 foram randomizados para 5-FU/LV + Avastin® (5 mg/kg, a cada duas semanas). Todos os tratamentos foram mantidos até a progressão da doença.
A adição de Avastin®, 5 mg/kg, a cada duas semanas, ao 5-FU/LV resultou em maiores taxas de resposta objetiva, sobrevida54 livre de progressão significativamente mais prolongada e tendência a sobrevida54 mais prolongada em comparação com a quimioterapia50 5-FU/LV apenas.
NO16966:
Esse foi um estudo clínico fase III, randomizado52, duplo-cego (para bevacizumabe), que investigou Avastin®, 7,5 mg/kg, em combinação com capecitabina oral e oxaliplatina IV (XELOX), administrado em um esquema de três semanas, ou Avastin®, 5 mg/kg, em combinação com leucovorin e 5-FU em bolus51, seguido de 5-FU infusional com oxaliplatina IV (FOLFOX-4), administrados em um esquema de duas semanas. Esse estudo continha duas partes: uma parte inicial de dois braços (parte I), na qual os pacientes foram divididos em dois braços de tratamento diferentes (XELOX e FOLFOX-4) e uma subsequente 2x2 fatorial (parte II), na qual os pacientes foram divididos em quatro braços de tratamento (XELOX + placebo53, FOLFOX-4 + placebo53, XELOX + Avastin®, FOLFOX-4 + Avastin®). Na parte II, a inclusão ao tratamento, em relação a Avastin® , foi duplo-cego.
Aproximadamente 350 pacientes foram randomizados para cada um dos quatro braços na parte II desse estudo.
Tabela 2. Regimes de tratamento: estudo NO16966 (CCRm)
O desfecho primário de eficácia desse estudo foi a duração da sobrevida54 livre de progressão.
Existiam dois desfechos primários: demonstrar que XELOX não era inferior a FOLFOX-4 e que Avastin® em combinação com FOLFOX-4 ou XELOX era superior à quimioterapia50 somente. Os dois objetivos coprimários foram alcançados.
a) A não inferioridade dos braços que continham XELOX em relação aos braços que continham FOLFOX-4, em uma comparação global, foi demonstrada em termos de sobrevida54 livre de progressão e sobrevida54 global na população elegível por protocolo.
b) A superioridade dos braços que continham Avastin® versus quimioterapia50 sem adição de Avastin® foi demonstrada em uma comparação global, em termos de sobrevida54 livre de progressão, na população com intenção de tratamento (vide Tabela 3).
A análise secundária de SLP, baseada no comitê de revisão independente (CRI) e nas respostas baseadas no subgrupo em tratamento, confirmou, de maneira significativa, o benefício clínico superior aos pacientes tratados com Avastin® (análise de subgrupo na Tabela 3), compatível com o benefício estatisticamente significativo observado na análise combinada.
Tabela 3. Resultados-chave de eficácia para a análise de superioridade (população intenção de tratamento, estudo NO16966)

ECOG E3200:
Esse foi um estudo clínico fase III, aberto, randomizado52, com controle ativo, que investigou Avastin®, 10 mg/kg, em combinação com leucovorin e 5-FU em bolus51, seguido de 5-FU infusional com oxaliplatina intravenosa (FOLFOX-4), administrado em um esquema de duas semanas, em pacientes previamente tratados (segunda linha) com câncer7 colorretal avançado. Nos braços de quimioterapia50, o regime FOLFOX-4 utilizou as mesmas doses e modo de administração do esquema adotado no estudo NO16966, como mostra a Tabela 2.
O desfecho primário de eficácia desse estudo foi a sobrevida54 global, definida como o tempo entre a randomização e óbito56 por qualquer causa. Oitocentos e vinte e nove pacientes foram selecionados aleatoriamente (292 FOLFOX-4, 293 Avastin® + FOLFOX-4 e 244 monoterapia com Avastin®). A adição de Avastin® a FOLFOX-4 resultou em prolongamento estatisticamente significativo da sobrevida54 global. Melhoras estatisticamente significativas em sobrevida54 livre de progressão e taxa de resposta objetiva também foram observadas (vide Tabela 4).
Tabela 4. Resultado de eficácia: estudo E3200

Não foi observada diferença significativa na duração de sobrevida54 global entre pacientes que receberam Avastin® em monoterapia comparados aos pacientes tratados com FOLFOX-4.
A sobrevida54 livre de progressão e a taxa de resposta objetiva foram inferiores no braço de Avastin® em monoterapia em comparação com o braço com FOLFOX-4.
Câncer7 de pulmão57 de não pequenas células6 localmente avançado, metastático ou recorrente
A segurança e a eficácia de Avastin® como tratamento de primeira linha de pacientes com câncer7 de pulmão57 de não pequenas células6, excluindo histologia predominantemente escamosa58, foram estudadas em associação com quimioterapia50 à base de platina nos estudos E4599 e BO17704.
E45996:
O estudo E4599 foi multicêntrico, aberto, randomizado52, controlado para avaliação de Avastin® como tratamento de primeira linha de pacientes com câncer7 de pulmão57 de não pequenas células6 localmente avançado, metastático ou recorrente, excluindo histologia predominantemente escamosa58.
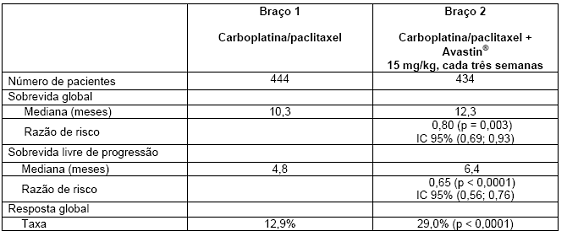
Os pacientes foram randomizados para receber quimioterapia50 à base de platina (paclitaxel 200 mg/m2 e carboplatina ASC = 6,0), ambos administrados por infusão IV, no dia 1 de cada ciclo de três semanas, até um total de seis ciclos, ou para o braço com carboplatina e paclitaxel em associação com Avastin®, na dose de 15 mg/kg, administrado por infusão IV no dia 1 de cada ciclo de três semanas. Após a conclusão dos seis ciclos de quimioterapia50 com carboplatina/paclitaxel ou após descontinuação prematura da quimioterapia50, os pacientes no braço de Avastin® + carboplatina/paclitaxel continuaram a receber Avastin® em monoterapia a cada três semanas até progressão da doença. Foram randomizados para os dois braços de tratamento 878 pacientes.
Durante o estudo, dos pacientes que receberam medicação de ensaio, 32,2% (136/422) receberam de 7 a 12 administrações de Avastin® e 21,1% (89/422) receberam 13 ou mais administrações de Avastin®.
O desfecho primário foi sobrevida54 global. Os resultados são apresentados na Tabela 5.
Tabela 5. Resultados de eficácia: estudo E4599
BO17704 7,8:
O estudo BO17704 foi de fase III, randomizado52, duplo-cego, com Avastin® em associação à cisplatina e gencitabina versus placebo53, cisplatina e gencitabina, em pacientes com câncer7 de pulmão57 de não pequenas células6 não escamoso59, localmente avançado, metastático ou recorrente, não previamente tratados com quimioterapia50. O desfecho primário foi a sobrevida54 livre de progressão (SLP), e os secundários incluíram a duração da resposta, sobrevida54 global e segurança.
Os pacientes foram randomizados para o braço de quimioterapia50 à base de platina, cisplatina 80 mg/m2, administrada por infusão IV, no dia 1, e 1.250 mg/m2 de gencitabina, administrada por infusão IV, nos dias 1 e 8 de cada ciclo, a cada três semanas até um total de seis ciclos (CG), com placebo53 ou para o braço de CG com Avastin®, na dose de 7,5 mg/kg ou 15 mg/kg, administrada por infusão IV, no dia 1 de cada ciclo, a cada três semanas. Nos braços que continham Avastin®, os pacientes receberam Avastin® em monoterapia a cada três semanas até progressão da doença ou toxicidade25 inaceitável.
Os resultados do estudo mostraram que 94% (277/296) dos doentes elegíveis continuaram a receber bevacizumabe em monoterapia no ciclo 7. Uma elevada proporção de pacientes (aproximadamente 62%) continuou a receber uma variedade de terapias antineoplásicas não especificadas no protocolo que podem ter impactado a análise da sobrevida54 global.
Os resultados de eficácia são apresentados na Tabela 6.
Tabela 6. Resultados de eficácia: estudo BO17704

Câncer7 de mama9 metastático (CMM) 9,10
ECOG E2100:
E2100 foi um estudo clínico multicêntrico, aberto, randomizado52, com controle-ativo, para avaliação de Avastin® em combinação com paclitaxel para câncer7 de mama9 metastático ou localmente recorrente em pacientes que não haviam recebido quimioterapia50 prévia para doença metastática12 ou localmente recorrente.
Terapia hormonal prévia para o tratamento de doença metastática12 foi permitida. Terapia adjuvante prévia com taxano foi permitida apenas se completada pelo menos 12 meses antes da inclusão no estudo.
Pacientes foram randomizados para receber paclitaxel em monoterapia (90 mg/m2, IV, em uma hora, uma vez por semana, por três ou quatro semanas) ou em combinação com Avastin® (10 mg/kg, infusão IV, a cada duas semanas). Os pacientes deveriam permanecer no estudo até a progressão da doença. Nos casos em que os pacientes descontinuaram a quimioterapia50 prematuramente, o tratamento com Avastin® em monoterapia foi mantido até a progressão da doença. O desfecho primário foi sobrevida54 livre de progressão (SLP), avaliada pelos investigadores. Adicionalmente, uma revisão independente dos desfechos primários também foi realizada. Dos 722 pacientes do estudo, a maioria tinha doença HER2 negativa (90%). Um pequeno número de pacientes tinha status HER2 desconhecido (8%) ou positivo (2%). Pacientes que estavam com HER2 positivo haviam sido previamente tratados com trastuzumabe ou foram considerados inadequados para trastuzumabe. A maioria, 65% dos pacientes, tinha recebido quimioterapia50 adjuvante, incluindo 19% que receberam terapia prévia com taxanos e 49% que receberam terapia prévia com antraciclinas. As características dos pacientes eram similares entre os braços de estudo.
Os resultados desse estudo estão apresentados na tabela 7.
Tabela 7. Resultados de eficácia do estudo E2100: pacientes elegíveis

Câncer7 de células6 renais metastático e/ou avançado (mRCC)11,12:
O estudo BO17705 foi um estudo de fase III, multicêntrico, randomizado52, duplo-cego, conduzido para avaliar a eficácia e a segurança de Avastin® em combinação com alfainterferona 2ª (Roferon®) versus alfainterferona 2a em monoterapia como tratamento de primeira linha em mRCC. Os 649 pacientes randomizados (641 tratados) tinham RCC de células6 claras metastático, desempenho Karnofsky ≥ 70%, ausência de metástases60 no sistema nervoso central61 e função orgânica adequada. O tratamento fornecido incluiu alfainterferona 2a (9 MUI, três vezes por semana) mais Avastin® (10 mg/kg, a cada duas semanas) ou placebo53, administrados até a progressão da doença. Os pacientes foram estratificados de acordo com o país e escore de Motzer, e os braços de tratamento mostraram ser equilibrados para os fatores de prognóstico62.
O desfecho primário foi a sobrevida54 global, com desfechos secundários para o estudo, incluindo sobrevida54 livre de progressão (SLP). A adição de Avastin® à alfainterferona 2a aumentou significativamente a SLP e a taxa de resposta objetiva do tumor55. Esses resultados foram confirmados através de uma revisão radiológica independente. No entanto, o aumento no desfecho primário de sobrevida54 global em dois meses não foi significativo (HR = 0,91). Uma alta proporção de pacientes (aproximadamente 63% IFN/placebo53, 55% Avastin®/IFN) recebeu uma série de terapias anticâncer pós-protocolo não especificadas, incluindo agentes antineoplásicos, que pode ter impactado na análise da sobrevida54 global.
Tabela 8. Resultados de eficácia: estudo BO17705
Um modelo de regressão de Cox multivariada exploratória utilizando seleção retrógada indicou que os seguintes fatores prognósticos basais estavam fortemente associados com a sobrevida54, independente do tratamento: sexo, contagem de glóbulos brancos, plaquetas34, perda de peso nos seis meses antecedentes à entrada no estudo, número de sítios metastáticos, soma do maior diâmetro das lesões63-alvo, escore de Motzer. O ajuste para esses fatores basais resultou em uma razão de risco de tratamento de 0,78 (95% IC [0,63; 0,96], p = 0,0219), indicando uma redução de 22% no risco de morte para os pacientes do braço Avastin® + alfainterferona 2a, em comparação com o braço alfainterferona 2a.
Noventa e sete (97) pacientes do braço alfainterferona 2a e 131 pacientes do braço de Avastin® reduziram a dose de alfainterferona 2a de 9 MUI para 6 ou 3 MUI, três vezes por semana, como pré-especificado no protocolo. A redução da dose da alfainterferona 2a pareceu não afetar a eficácia do uso combinado de Avastin® e alfainterferona 2a, com base nas taxas de SLP livres de eventos ao longo do tempo, como mostrado por uma análise de subgrupo. Os 131 pacientes do braço Avastin® + alfainterferona 2a que reduziram e mantiveram a dose de alfainterferona 2a em 6 ou 3 MUI durante o estudo exibiram em 6, 12 e 18 meses, taxas de SLP livres de eventos de 73, 52 e 21%, respectivamente, em comparação com 61, 43 e 17% na população total de pacientes tratados com Avastin® + alfainterferona 2a.
AVF2938:
Foi um estudo clínico de fase II, randomizado52, duplo-cego, para avaliar Avastin®, 10 mg/kg, em um esquema a cada duas semanas, com a mesma dose de Avastin® em combinação com 150 mg/dia de erlotinibe, em pacientes com RCC de células6 claras metastático. Foram randomizados 104 pacientes para o tratamento nesse estudo, 53 para 10 mg/kg de Avastin®, a cada duas semanas, mais placebo53, e 51 para 10 mg/kg de Avastin®, a cada duas semanas, mais erlotinibe, 150 mg/dia. A análise do desfecho primário não mostrou diferença entre o braço de Avastin® + placebo53 e o de Avastin® + erlotinibe (mediana de SLP de 8,5 versus 9,9 meses). Sete pacientes em cada braço apresentaram uma resposta objetiva.


