
REAÇÕES ADVERSAS DOCETAXEL
AS REAÇÕES ADVERSAS CONSIDERADAS POSSÍVEIS OU PROVAVELMENTE RELACIONADAS À ADMINISTRAÇÃO DE DOCETAXEL FORAM OBSERVADAS EM PACIENTES TRATADOS EM MONOTERAPIA OU EM ASSOCIAÇÃO COM PARÂMETROS DA FUNÇÃO HEPÁTICA1 NORMAIS NO ESTADO BASAL. ENTRE OS PACIENTES TRATADOS COM MONOTERAPIA, 1312 RECEBERAM 100 MG/M2 E 121 RECEBERAM 75 MG/M2 DE DOCETAXEL. ENTRE OS PACIENTES QUE RECEBERAM DOCETAXEL EM ASSOCIAÇÃO COM DOXORRUBICINA NA DOSE DE 50 MG/M2, 258 RECEBERAM 75 MG/M2 DE DOCETAXEL.
OS RELATOS A SEGUIR DESCREVEM AS REAÇÕES ADVERSAS CONHECIDAS OCORRIDAS EM PACIENTES TRATADOS COM 100 MG/M2 DE DOCETAXEL EM MONOTERAPIA, NOS ESTUDOS CLÍNICOS E DE PÓS-COMERCIALIZAÇÃO.
REAÇÕES HEMATOLÓGICAS
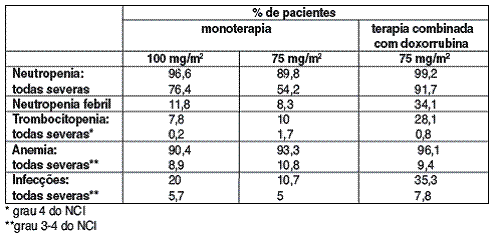
SUPRESSÃO DA MEDULA ÓSSEA2 E OUTRAS REAÇÕES ADVERSAS HEMATOLÓGICAS AO DOCETAXEL INCLUEM: NEUTROPENIA3 FOI A REAÇÃO ADVERSA MAIS FREQUENTE (96,6% DOS CASOS) EM PACIENTES QUE NÃO RECEBERAM FATOR ESTIMULADOR DE COLÔNIAS DE GRANULÓCITOS4) E MOSTROU-SE REVERSÍVEL E NÃO CUMULATIVA.
ATINGIU-SE O NADIR EM MÉDIA NO SÉTIMO DIA E A DURAÇÃO MÉDIA DA NEUTROPENIA3 SEVERA (76,4%, < 500 CÉLULAS5/MM3) FOI DE SETE DIAS.
A TABELA ABAIXO MOSTRA A FREQÜÊNCIA DAS REAÇÕES ADVERSAS TANTO EM MONOTERAPIA, QUANTO EM TERAPIA COMBINADA6 COM DOXORRUBICINA:
REAÇÕES DE HIPERSENSIBILIDADE
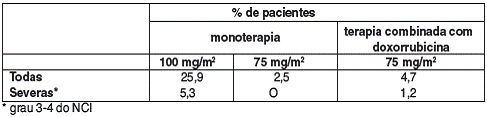
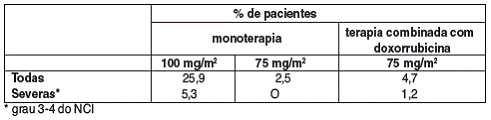
REAÇÕES DE HIPERSENSIBILIDADE (25,9%), OCORRENDO GERALMENTE DENTRO DE POUCOS MINUTOS APÓS O INÍCIO DA INFUSÃO DE DOCETAXEL, USUALMENTE SÃO DE INTENSIDADE LEVE A MODERADA. OS SINTOMAS7 FREQÜENTEMENTE RELATADOS FORAM RUBOR, RASH8 COM OU SEM PRURIDO9, DIFICULDADE INSPIRATÓRIA, DOR LOMBAR, DISPNÉIA10 E FEBRE11 MEDICAMENTOSA OU CALAFRIO12. REAÇÕES SEVERAS (5,3%) DESAPARECERAM APÓS DESCONTINUAÇÃO DA INFUSÃO DE DOCETAXEL E EMPREGO DE TERAPIA APROPRIADA.
REAÇÕES CUTÂNEAS13
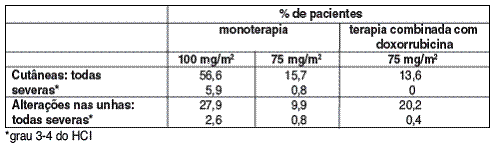
OBSERVOU-SE REAÇÕES CUTÂNEAS13 REVERSÍVEIS (56,6%) GERALMENTE CONSIDERADAS DE INTENSIDADE LEVE A MODERADA.
AS REAÇÕES FORAM CARACTERIZADAS POR RASH8, INCLUINDO ERUPÇÕES LOCALIZADAS PRINCIPALMENTE NOS PÉS, MÃOS14, MAS TAMBÉM NOS BRAÇOS, FACE15 OU TÓRAX16, E FREQÜENTEMENTE ASSOCIADAS COM PRURIDO9. GERALMENTE OCORRERAM ERUPÇÕES DENTRO DE UMA SEMANA APÓS A INFUSÃO DE DOCETAXEL.
SINTOMAS7 SEVEROS COMO ERUPÇÃO17 SEGUIDA POR DESCAMAÇÃO18, QUE RARAMENTE CAUSARAM A INTERRUPÇÃO OU DESCONTINUAÇÃO DO TRATAMENTO COM DOCETAXEL, FORAM RELATADOS COM MENOR FREQÜÊNCIA (5,9%). OCORRERAM ALTERAÇÕES NAS UNHAS19 (27,9%) CARACTERIZADAS PELA HIPO OU HIPERPIGMENTAÇÃO, DOR E ONICÓLISE20.
CASOS MUITO RAROS DE ERUPÇÃO17 BOLHOSA COMO ERITEMA MULTIFORME21 OU SÍNDROME DE STEVENS-JOHNSON22 TÊM SIDO RELATADOS COM DOCETAXEL. VÁRIOS FATORES COMO INFECÇÕES23 SIMULTÂNEAS, USO CONCOMITANTE DE MEDICAMENTOS E DOENÇAS PRÉ-EXISTENTES PODEM TER CONTRIBUÍDO PARA O DESENVOLVIMENTO DESTAS REAÇÕES.
RETENÇÃO HÍDRICA
REAÇÕES ADVERSAS RELACIONADAS À RETENÇÃO HÍDRICA FORAM OBTIDAS DE 92 PACIENTES TRATADOS COM 100 MG/M2 DE DOCETAXEL EM MONOTERAPIA, POR MEIO DE ANÁLISE RETROSPECTIVA NO 3° DIA DA ADMINISTRAÇÃO DE PRÉ-MEDICAÇÃO.
OBSERVOU-SE RETENÇÃO HÍDRICA EM 64,1% (SENDO 6,5 % DOS CASOS SEVERA) DOS PACIENTES QUE RECEBERAM 3 DIAS DE PRÉ-MEDICAÇÃO. FORAM RELATADOS EVENTOS COMO EDEMA24 PERIFÉRICO E COM MENOR FREQÜÊNCIA DERRAME25 PLEURAL, DERRAME25 PERICÁRDICO, ASCITE26 E AUMENTO DE PESO. O EDEMA24 PERIFÉRICO GERALMENTE INICIA-SE NAS EXTREMIDADES INFERIORES E PODE GENERALIZAR-SE COM UM AUMENTO DE PESO IGUAL OU SUPERIOR A 3 KG. A RETENÇÃO HÍDRICA É CUMULATIVA EM INCIDÊNCIA27 E GRAVIDADE (VIDE ITEM ‘PRECAUÇÕES E ADVERTÊNCIAS”).
EM PACIENTES TRATADOS COM 100 MG/M2 DE DOCETAXEL EM MONOTERAPIA, A DOSE CUMULATIVA MEDIANA PARA INTERRUPÇÃO DO TRATAMENTO FOI SUPERIOR A 1.000 MG/M2 E O TEMPO MÉDIO PARA A REVERSIBILIDADE DA RETENÇÃO HÍDRICA FOI DE 16,4 SEMANAS (INTERVALO DE 0 A 42 SEMANAS). EM PACIENTES TRATADOS COM PRÉ-MEDICAÇÃO, O INÍCIO DA RETENÇÃO MODERADA E SEVERA É RETARDADO (DOSE CUMULATIVA MÉDIA: 818,9 MG/ M2), QUANDO COMPARADOS AOS PACIENTES SEM PRÉ-MEDICAÇÃO (DOSE CUMULATIVA MÉDIA: 489,7 M2); CONTUDO, RELATOU-SE RETENÇÃOHÍDRICA EM ALGUNS PACIENTES DURANTE OS PRIMEIROS CICLOS DO TRATAMENTO.
A RETENÇÃO HÍDRICA NÃO TEM SIDO ACOMPANHADA POR EPISÓDIOS AGUDOS DE OLIGÚRIA28 OU HIPOTENSÃO29. DESIDRATAÇÃO30 E EDEMA PULMONAR31 TÊM SIDO RARAMENTE RELATADOS.
REAÇÕES GASTRINTESTINAIS
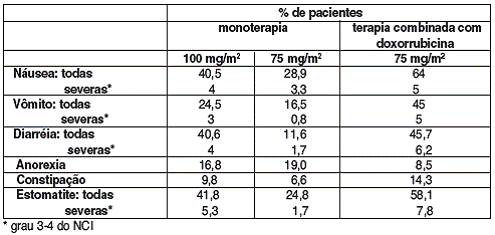
AS SEGUINTES REAÇÕES GASTRINTESTINAIS FORAM RELATADAS: 40,5% = NÁUSEA32 (4% DOS CASOS SEVERA), 24,5% = VÔMITO33 (3% DOS CASOS SEVERA), 40,6% = DIARRÉIA34 (4% DOS CASOS SEVERA), 7,3% = DOR ABDOMINAL (1% DOS CASOS SEVERA), 16,8% = ANOREXIA35, 9,8% = CONSTIPAÇÃO36 (0,2% DOS CASOS SEVERA), 41,8% = ESTOMATITE37 (5,3% DOS CASOS SEVERA), 1% = ESOFAGITE38 (0,4% DOS CASOS SEVERA), 10,1% = PERVERSÃO DO PALADAR39 (0,07% DOS CASOS SEVERA), 1,4% = SANGRAMENTO GASTRINTESTINAL (0,3% DOS CASOS SEVERA). FORAM RELATADOS RAROS CASOS DE DESIDRATAÇÃO30 RESULTANTE DE EVENTOS GASTRINTESTINAIS, PERFURAÇÃO GASTRINTESTINAL, COLITE40 ISQUÊMICA, COLITE40 E ENTEROCOLITE NEUTROPÊNICA,
ALÉM DE CASOS MUITO RAROS DE OBSTRUÇÃO DO ÍLEO41 E DO INTESTINO.
REAÇÕES NEUROLÓGICAS
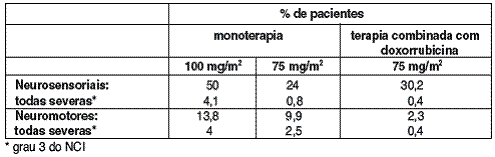
SINAIS42 E/OU SINTOMAS7 NEUROSENSORIAIS DE INTENSIDADE LEVE A MODERADA OCORRERAM EM 50% DOS PACIENTES. SINTOMAS7 NEUROSENSORIAIS SEVEROS (PARESTESIA43, DISESTESIA44, DOR INCLUINDO ARDOR45) FORAM OBSERVADOS EM 4,1% DOS PACIENTES COM CÂNCER46 DE MAMA47 METÁSTATICO, NECESSITANDO INTERRUPÇÃO EM 2% DOS CASOS. EVENTOS NEUROMOTORES (13,8% SENDO SEVEROS EM 4% DOS CASOS) PRINCIPALMENTE CARACTERIZADOS POR FRAQUEZA. QUANDO ESTES SINTOMAS7 OCORREREM, A DOSE DEVE SER AJUSTADA. EM CASO DE PERSISTÊNCIA DOS SINTOMAS7, O TRATAMENTO DEVE SER INTERROMPIDO (VIDE ITEM “POSOLOGIA E ADMINISTRAÇÃO”). PACIENTES QUE APRESENTARAM NEUROTOXICIDADE NOS ESTUDOS CLÍNICOS E PARA OS QUAIS A INFORMAÇÃO DE ACOMPANHAMENTO SOBRE A RESOLUÇÃO COMPLETA DO EVENTO ESTEJA DISPONÍVEL, APRESENTARAM REVERSÃO ESPONTÂNEA DOS SINTOMAS7 COM UMA MÉDIA DE 81 DIAS DO INÍCIO (VARIAÇÃO: O A 741 DIAS).
COM A ADMINISTRAÇÃO DE DOCETAXEL OBSERVOU-SE RARAMENTE CASOS DE CONVULSÃO48 OU PERDA TRANSITÓRIA DA CONSCIÊNCIA. ALGUMAS VEZES ESTAS REAÇÕES APARECEM DURANTE A INFUSÃO DO MEDICAMENTO.
REAÇÕES CARDIOVASCULARES
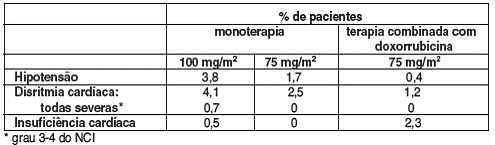
OS EVENTOS CARDIOVASCULARES CONSISTIRAM EM: HIPOTENSÃO29 (3,8%), DISRITMIA (4,1%), HIPERTENSÃO49 (2,4%) E INSUFICIÊNCIA CARDÍACA50 (0,5%).
FORAM RELATADOS RARAMENTE EPISÓDIOS DE TROMBOEMBOLISMO51 VENOSO E INFARTO DO MIOCÁRDIO52.
REAÇÕES HEPÁTICAS53
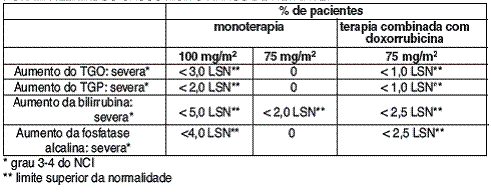
EM PACIENTES TRATADOS COM 100 MG/M2 DE DOCETAXEL COMO MONOTERAPIA, FORAM OBSERVADOS AUMENTOS DOS NÍVEIS PLASMÁTICOS DAS TRANSAMINASES (TGP/TGO), BILIRRUBINA54 E FOSFATASE ALCALINA55, SUPERIORES A 2,5 VEZES O LIMITE SUPERIOR DA NORMALIDADE, EM MENOS DE 5% DOS PACIENTES.
FORAM RELATADOS CASOS MUITO RAROS DE HEPATITE56.
OUTROS
ALOPECIA57 (79% SENDO SEVERA EM 0,5% DOS CASOS), ASTENIA58 (62,6% SENDO SEVERA EM 11,2% DOS CASOS), ARTRALGIA59 (8,6%), MIALGIA60 (20%), DISPNÉIA10 (16,1% SENDO SEVERA EM 2,7% DOS CASOS), DOR GENERALIZADA OU LOCALIZADA (16,5% SENDO SEVERA EM 0,8% DOS CASOS), INCLUINDO DOR TORÁCICA (4,5% SENDO SEVERA EM 0,4% DOS CASOS) SEM QUALQUER ENVOLVIMENTO RESPIRATÓRIO OU CARDÍACO.
FORAM RELATADOS RAROS CASOS DE LACRIMEJAMENTO COM OU SEM CONJUNTIVITE61 E CASOS MUITO RAROS DE OBSTRUÇÃO DO DUCTO LACRIMAL RESULTANDO NO LACRIMEJAMENTO EXCESSIVO, PRINCIPALMENTE EM PACIENTES RECEBENDO TERAPIA COMBINADA6 COM OUTROS AGENTES ANTITUMORAIS.
REAÇÕES NO LOCAL DE INFUSÃO FORAM GERALMENTE MODERADAS E CONSISTIRAM DE HIPERPIGMENTAÇÃO, INFLAMAÇÃO62, VERMELHIDÃO OU SECURA DA PELE63, FLEBITE64 OU EXTRAVASAMENTO E INGURGITAMENTO VENOSO.
CASOS DE SÍNDROME65 DE DIFICULDADE RESPIRATÓRIA AGUDA, PNEUMONIA66 INTERSTICIAL67, FIBROSE68 PULMONAR E FENÔMENOS DE REAPARECIMENTO DOS EFEITOS DA RADIAÇÃO FORAM RELATADOS RARAMENTE.
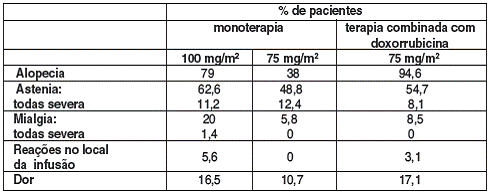
DE UMA FORMA GERAL, OS EVENTOS ADVERSOS PADRÕES OBSERVADOS NOS PACIENTES TRATADOS COM DOCETAXEL EM TERAPIA COMBINADA6 COM DOXORRUBICINA SÃO SIMILARES ÀQUELES OBSERVADOS EM PACIENTES TRATADOS COM DOCETAXEL EM MONOTERAPIA.
- POSOLOGIA E ADMINISTRAÇÃO:
Posologia recomendada
Para os pacientes em tratamento de câncer46 de mama47, a posologia recomedada de docetaxel em monoterapia é de 100 mg/m2, administrada em infusão de 1 hora, a cada 3 semanas. Em caso de terapia combinada6, a posologia recomendada de docetaxel é de 75 mg/m 2 em associação com doxorrubicina (50 mg/m2) (vide sub-item “Instrução de preparo”). Para os pacientes em tratamento de câncer46 de ovário69, a posologia recomendada de docetaxel é de 100 mg/m2, administrada em infusão de 1 hora, a cada 3 semanas (vide sub-item “Instrução de preparo”). Os pacientes devem ser rigorosamente monitorados principalmente durante a primeira e a segunda infusão de docetaxel, devido ao risco de reações de hipersensibilidade (vide item “Precauções e Advertências”).
Para os pacientes em tratamento de câncer46 de pulmão70 de não-pequenas células5, a posologia recomendada de docetaxel é de 75 a 100 mg/m2 em monoterapia, e de no máximo 75 mg/m2 em caso de associação com derivados de platina, administrada em infusão de 1 hora, a cada 3 semanas.
Uma pré-medicação oral com corticosteróide como 16 mg/dia (por exemplo 8 mg duas vezes 10 dia) de dexametasona durante 3 dias, com início no dia anterior á administração de docetaxel, a menos que contra-indicada, pode ser utilizada (vide item “Precauções e Advertências”).
Ajuste posológico durante o tratamento
Docetaxel não deve ser administrado até que a contagem neutrofílica seja ≥ 1500 células5/mm3.
Os pacientes que apresentem neutropenia3 febril, contagem de neutrófilos71 < 500 células5/mm 3 durante mais de uma semana, reações cutâneas13 severas ou cumulativas ou neuropatias periféricas severas durante a terapia com docetaxel, deverão ter a dose reduzida de 100 mg/ m2 para 75 mg/m2 ou de 75 mg/m2 para 60 mg/m2. Caso o paciente continue a apresentar as mesmas reações com a dose de 60 mg/m2, o tratamento deve ser descontinuado.
Alternativamente, pode-se utilizar tratamento profilático com G-CSF em pacientes com neutropenia3 febril ou infecção72 severa anteriores, com o intuito de manter a intensidade da dose.
Populações especiais
Pacientes com insuficiência hepática73: com base nos dados farmacocinéticos obtidos com a administração de 100 mg/m2 de docetaxel em monoterapia, a dose recomendada para pacientes74 que apresentam simultaneamente aumento de transaminases (TGP e/ou TGO) > 1,5 vezes o limite superior da normalidade e de fosfatase alcalina55 > 2,5 vezes o limite superior da normalidade é de 75 mg/m2. Em pacientes com nível plasmático de bilirrubina54 maior do que o limite superior da normalidade e/ou níveis de TGP e TGO > 3,5 vezes o limite superior da normalidade associado a níveis de fosfatase alcalina55 > 6 vezes o limite superior da normalidade, não se deve realizar ajuste posológico e docetaxel não deve ser utilizado, a menos que estritamente indicado. Não existem dados disponíveis em pacientes com insuficiência hepática73 tratados com docetaxel em terapia combinada6.
Crianças: A eficácia e segurança da administração de docetaxel em crianças ainda não foram estabelecidas.
Idosos: Com base na análise farmacocinética desta população, não há necessidade de instruções especiais na administração de docetaxel em idosos.
Instruções de preparo
Recomendações para o manuseio seguro
Docetaxel é um agente antineoplásico, e assim como com outros compostos potencialmente tóxicos, deve-se ter cautela na manipulação e no preparo das soluções de docetaxel. É recomendado o uso de luvas.
Caso a solução de docetaxel concentrado, solução pré-mistura ou solução para infusão entre em contato com a pele63, deve-se lavar a região com água e sabão, imediata e completamente, sem esfregar. Caso a solução de docetaxel concentrado, solução pré-mistura ou solução para infusão entre em contato com membranas mucosas75, lave-as imediata e completamente com água.
Preparo da solução para administração intravenosa
A) Preparo da Solução Pré-mistura de docetaxel - 10 mg/mL
1. Como os frascos-ampola de docetaxel são conservados sob refrigeração, retire um número apropriado de frascos-ampola de docetaxel com os seus respectivos frascosampola de diluente do refrigerador, deixando-os em temperatura ambiente por 5 minutos.
2. Com o auxílio de uma seringa76 com agulha, retire assepticamente a quantidade total do frasco-ampola de diluente, invertendo parcialmente o frasco-ampola.
3. Injete a quantidade total de diluente contido na seringa76 no frasco-ampola de docetaxel.
4. Retire a seringa76 com agulha do frasco-ampola e misture o frasco-ampola manualmente por meio de inversões repetidas durante pelo menos 45 segundos. Não agite.
5. Deixe o frasco-ampola em repouso durante 5 minutos em temperatura ambiente e verifique visualmente se a solução obtida é homogênea e límpida, podendo haver presença de espuma, mesmo após os 5 minutos de repouso, devido á presença de polissorbato 80 na formulação. Esta é a solução pré-mistura de docetaxel, cuja concentração é de 10 mg/ mL.
A solução pré-mistura de docetaxel deve ser utilizada imediatamente após o seu preparo.
B) Preparo da Solução para Infusão
A solução pré-mistura contém 10 mg/mL de docetaxel e deve ser utilizada imediatamente no preparo da solução para infusão.
1. Pode ser necessário mais do que um frasco de solução pré-mistura de docetaxel para se obter a dose necessária ao paciente. Com base na dose requerida para o paciente expressa em mg, retire assepticamente, com o auxílio de uma seringa76 com agulha, o volume necessário de solução pré-mistura de docetaxel , contendo 10 mg/mL.
Por exemplo: uma dose de 140 mg de docetaxel requer 14 mL de solução pré-mistura docetaxel.
2. Transfira este volume para uma bolsa ou frasco de infusão com 250 mL de solução de cloreto de sódio 0,9% ou de solução glicosada a 5%.
Caso seja necessária uma dose maior que 200 mg de docetaxel, utilize um volume superior de veículo de infusão, visando não exceder a concentração de 0,74 mg/mL de docetaxel.
3. Misture o conteúdo da bolsa ou frasco de infusão manualmente, utilizando movimento oscilante.
4. A solução para infusão de docetaxel deve ser administrada assepticamente por via intravenosa dentro de um período de 4 horas, incluindo 1 hora de infusão, em condições de temperatura ambiente e luminosidade normal.
5. Assim como para qualquer medicamento de uso parenteral, a solução pré-mistura e a solução para infusão de docetaxel devem ser verificadas visualmente antes do uso.
Soluções contendo precipitados devem ser descartadas.
Todos os materiais utilizados na diluição e administração de docetaxel devem ser descartados, seguindo procedimentos padrões.
A solução para infusão de docetaxel é compatível com materiais e dispositivos mais comumente usados, incluindo o PVC.


