
MECANISMO DE AÇÃO ZART
A angiotensina II, um potente vasoconstritor, é o principal hormônio1 ativo do sistema renina angiotensina e o maior determinante da fisiopatologia2 da hipertensão3. A angiotensina II liga-se ao receptor AT1 encontrado em muitos tecidos (por exemplo, músculo liso vascular4, glândulas5 adrenais, rins6 e coração7) e desencadeia várias ações biológicas importantes, incluindo vasoconstrição8 e liberação de aldosterona. A angiotensina II também estimula a proliferação de células musculares9 lisas. Foi identificado um segundo receptor da angiotensina II subtipo AT2, cuja função na homeostase cardiovascular é desconhecida.
A losartana potássica é um composto sintético potente, ativo por via oral. Em bioensaios de ligação e farmacológicos, liga-se seletivamente ao receptor AT1. In vitro e in vivo, tanto a losartana potássica quanto seu metabólito10 ácido carboxílico farmacologicamente ativo (E-3174) bloqueiam todas as ações fisiologicamente relevantes da angiotensina II, independentemente da fonte ou via de síntese.
Diferentemente de alguns antagonistas peptídicos da angiotensina II, a losartana potássica não apresenta efeitos agonistas.
A losartana potássica liga-se seletivamente ao receptor AT1 e não se liga ou bloqueia outros receptores de hormônios ou canais iônicos importantes na regulação cardiovascular. Além disso, a losartana potássica não inibe a ECA (cininase II), a enzima11 que degrada a bradicinina12.
Consequentemente, os efeitos não relacionados diretamente ao bloqueio do receptor AT1, como a potencialização dos efeitos mediados pela bradicinina12 ou o desenvolvimento de edema13 (losartana potássica: 1,7%; placebo14: 1,9%), não estão associados à losartana potássica.
Absorção
Após a administração oral, a losartana potássica é bem absorvido e sofre metabolismo15 de primeira passagem, formando um metabólito10 ácido carboxílico ativo e outros metabólitos16 inativos. A biodisponibilidade sistêmica dos comprimidos de losartana potássica é de aproximadamente 33%. As concentrações máximas médias de losartana potássica e de seu metabólito10 ativo são atingidas em 1 hora e em 3 a 4 horas, respectivamente. Não houve efeito clinicamente significativo no perfil da concentração plasmática de losartana potássica quando o fármaco17 foi administrado com uma refeição-padrão.
Distribuição
Tanto a losartana potássica como seu metabólito10 ativo apresentam taxa de ligação a proteínas18 plasmáticas > 99%, principalmente com a albumina19. O volume de distribuição da losartana é de 34 litros. Estudos em ratos indicam que a losartana praticamente não atravessa a barreira hematoencefálica.
Metabolismo15
Aproximadamente 14% da dose de losartana administrada por via intravenosa ou oral são convertidos ao seu metabólito10 ativo. Após a administração intravenosa ou oral de losartana potássica marcado com 14C, a radioatividade plasmática circulante principal é atribuída a losartana e ao seu metabólito10 ativo.
Observou-se conversão mínima de losartana potássica ao seu metabólito10 ativo em aproximadamente 1% dos indivíduos estudados.
Além do metabólito10 ativo, são formados metabólitos16 inativos, incluindo dois principais formados por hidroxilação da cadeia lateral butílica e um secundário, um glucuronídeo N-2 tetrazol.
Eliminação
A depuração plasmática de losartana e de seu metabólito10 ativo é de aproximadamente 600 ml/min e 50 ml/min, respectivamente. A depuração renal20 de losartana e de seu metabólito10 ativo é de aproximadamente 74 ml/min e 26 ml/min, respectivamente. Quando a losartana é administrado por via oral, aproximadamente 4% da dose é excretada inalterada na urina21 e 6%, na forma de metabólito10 ativo. As farmacocinéticas de losartana e de seu metabólito10 ativo são lineares com doses de losartana potássica de até 200 mg, administradas por via oral.
Após a administração oral, as concentrações plasmáticas de losartana e de seu metabólito10 ativo diminuem poliexponencialmente, com meia-vida final de aproximadamente 2 horas e de 6 a 9 horas, respectivamente. Durante a administração da dose única diária de 100 mg, a losartana e seu metabólito10 ativo não se acumulam significativamente no plasma22.
Tanto a excreção biliar como a urinária contribuem para a eliminação de losartana potássica e seus metabólitos16.
Após dose oral de losartana potássica marcado com 14C em humanos, aproximadamente 35% da radioatividade é recuperada na urina21 e 58%, nas fezes. Após dose intravenosa de losartana potássica marcado com 14C em humanos, aproximadamente 43% da radioatividade é recuperada na urina21 e 50%, nas fezes.
- RESULTADOS DE EFICÁCIA
Estudos de Hipertensão3
A eficácia anti-hipertensiva de losartana potássica foi demonstrada em 11 estudos controlados envolvendo 1.679 pacientes no grupo losartana potássica 471 pacientes no grupo placebo14 e 488 pacientes que receberam uma variedade de agentes comparadores.A administração em dose única diária de losartana potássica a pacientes com hipertensão3 essencial leve à moderada causou reduções estatisticamente significativas das pressões arteriais sistólica e diastólica; nos estudos clínicos, o efeito anti-hipertensivo foi mantido por até um ano. A medida da pressão arterial23 no vale (24 horas após a dose) em relação à pressão no pico (5 a 6 horas após a dose) demonstrou redução da pressão arterial23 relativamente uniforme nas 24 horas. O efeito anti-hipertensivo acompanhou os ritmos diurnos naturais. A redução da pressão arterial23 no final do intervalo posológico foi de aproximadamente 70% a 80% do efeito observado 5 a 6 horas após a dose. O efeito anti-hipertensivo máximo foi atingido 3-6 semanas após o início da terapia. Apesar da diminuição significativa da pressão arterial23, a administração de losartana potássica não exerceu efeito clinicamente significativo na freqüência cardíaca. A descontinuação de losartana em pacientes hipertensos não resultou em rebote abrupto da pressão arterial23.
A administração de 50 mg a 100 mg de losartana potássica uma vez ao dia produziu efeito anti-hipertensivo significativamente maior do que a administração de 50 mg a 100 mg de captopril uma vez ao dia. O efeito anti-hipertensivo da administração única de losartana potássica 50 mg foi semelhante ao da administração única diária de enalapril 20 mg. O efeito anti-hipertensivo da administração única diária de 50 mg a 100 mg de losartana potássica foi comparável ao da administração única diária de 50 mg a 100 mg de atenolol e também foi equivalente ao da administração de 5 mg a 10 mg de felodipina de liberação prolongada em hipertensos mais velhos ( ≥ 65 anos) após 12 semanas de terapia.
Losartana potássica é igualmente eficaz em pacientes hipertensos de ambos os sexos e em pacientes hipertensos mais jovens (<65 anos de idade) e mais velhos (≥65 anos de idade). Embora o efeito anti-hipertensivo de losartana potássica tenha se manifestado em todas as raças estudadas e, a exemplo do que ocorre com outros medicamentos que afetam o sistema renina-angiotensina, a resposta média à monoterapia com losartana potássica foi menor em pacientes da raça negra.
Os efeitos de losartana potássica administrado concomitantemente com diuréticos24 tiazídicos na redução da pressão arterial23 são aproximadamente aditivos.
Como losartana potássica bloqueia de forma seletiva o sítio do receptor da angiotensina II, espera-se que os pacientes tratados com losartana potássica não apresentem tosse. Em um estudo controlado de 8 semanas sobre a incidência25 de tosse em pacientes hipertensos com história de tosse durante a terapia com um inibidor da ECA, as incidências de tosse relatadas pelos pacientes tratados com losartana potássica ou por um agente não-associado à tosse induzida por um inibidor da ECA (hidroclorotiazida) foram semelhantes e significativamente menores que a de pacientes submetidos a nova exposição a um inibidor da ECA. Além disso, em uma análise global de 16 estudos clínicos duplo-cegos conduzidos em 4.131 pacientes, a incidência25 de tosse relatada de forma espontânea em pacientes tratados com losartana potássica foi semelhante (3,1%) à de pacientes tratados com o placebo14 (2.6%) ou com a hidroclorotiazida (4,1%), ao passo que a incidência25 com inibidores da ECA foi de 8,8%.
O Estudo LIFE: O estudo Losartan Intervention For Endpoint reduction in hypertension (LIFE) foi um estudo de grande porte, multicêntrico, multinacional, randômico, triplo-cego, controlado com medicação ativa, que envolveu 9.193 pacientes hipertensos com idades entre 55 e 80 anos (média de 67 anos) e hipertrofia26 ventricular esquerda documentada por ECG. No período basal, 1.195 (13%) dos pacientes apresentavam diabetes27; 1.326 (14%), hipertensão3 sistólica isolada; 1.468 (17%), doença coronariana28; e 728 (8%), doença vascular29 cerebral. O objetivo do estudo foi demonstrar os efeitos protetores cardio-vasculares30 de losartana potássica versus atenolol, acima e além dos benefícios do controle da pressão arterial23 apenas (medida no vale). Para atingir esse objetivo, a meta da pressão arterial23 foi a mesma nos dois grupos de tratamento. Os pacientes foram distribuídos de modo randômico para receber 50 mg de losartana potássica ou 50 mg de atenolol uma vez ao dia. Quando a meta da pressão arterial23 (<140/90 mmHg) não era atingida, adicionava-se, em primeiro lugar, a hidroclorotiazida (12,5 mg) e, se necessário, aumentava-se a dose de losartana potássica ou de atenolol para 100 mg uma vez ao dia. Se ainda fosse necessário para atingir a meta, eram feitas outras modificações do esquema terapêutico (por exemplo, aumento da dose de hidroclorotiazida para 25 mg ou adição de outra terapia diurética ou de bloqueadores dos canais de cálcio, de alfabloqueadores, ou de agentes de ação central). A adição de inibidores da ECA, antagonistas da angiotensina II ou betabloqueadores não foi permitida.
Nos dois grupos de tratamento, a pressão arterial23 foi significativamente reduzida para níveis semelhantes e proporção semelhante de pacientes atingiu a meta da pressão arterial23. A duração média do período de acompanhamento foi de 4,8 anos.
O desfecho primário foi o composto de morbidade31 e mortalidade32 cardiovasculares avaliado pela redução da incidência25 combinada de morte cardiovascular, acidente vascular cerebral33 e infarto do miocárdio34. Os resultados mostraram que o tratamento com losartana potássica resultou em 13,0% de redução do risco (p= 0,021) em comparação com o atenolol para os pacientes que atingiram o desfecho primário composto (veja a Figura 1).
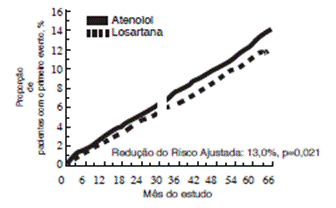
Figura 1. Estimativas de Kaplan-Meier do desfecho primário composto de morte cardiovascular,
acidente vascular cerebral33 ou infarto do miocárdio34 nos grupos que receberam losartana potássica e atenolol, ajustadas para o escore de risco de Framingham e o grau de hipertrofia26 ventricular esquerda ao ECG no período basal.
O tratamento com losartana potássica reduziu o risco de acidente vascular cerebral33 em 25% comparativamente ao atenolol (p= 0,001). As taxas de morte cardiovascular e de infarto do miocárdio34 não foram significativamente diferentes entre os grupos de tratamento. O efeito de losartana potássica no desfecho primário composto, aparentemente, foi superior e além dos efeitos benéficos do controle da pressão arterial23 apenas (veja Tabela a seguir).
DESFECHOS DO ESTUDO LIFE
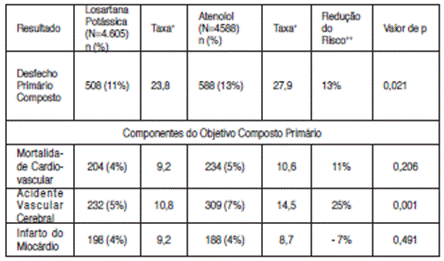
+ Por 1.000 pacientes-anos de acompanhamento;
++ Ajustada para o escore de risco de Framingham e o grau de HVE ao ECG no período basal;
Os outros desfechos clínicos do estudo LIFE foram: mortalidade32 por todas as causas, hospitalização por insuficiência cardíaca35 ou angina36 pectoris, procedimentos de revascularização coronariana ou periférica e parada cardíaca com ressuscitação. Não ocorreram diferenças significativas entre os grupos de tratamento nas taxas desses desfechos. Os pacientes que receberam losartana potássica apresentaram redução significativamente maior dos índices de hipertrofia26 ventricular esquerda ao ECG em comparação aos pacientes que receberam atenolol.
Os efeitos de losartana potássica versus atenolol na morbimortalidade cardiovasculares foram examinados em subgrupos de pacientes com histórico de diabetes27 mellitus (n= 1.195) ou de hipertensão3 sistólica isolada (ISH) (n= 1.326) no período basal. Em relação ao desfecho primário composto, os resultados observados nesses subgrupos foram compatíveis com o benefício da terapia com losartana potássica observado na população global do estudo: nos pacientes com diabetes27, observou-se redução de 24% do risco (p= 0,03) e nos pacientes com hipertensão3 sistólica isolada, de 25% (p= 0,06). Compatível com os resultados observados na população global, a redução do risco de acidente vascular cerebral33 foi um importante fator contribuinte para o benefício observado nos pacientes com diabetes27 ou ISH.
Raça: Com base no estudo LIFE, os benefícios de losartana potássica sobre a morbidade31 e a mortalidade32 cardiovasculares em comparação com os do atenolol não se aplicam a pacientes negros com hipertensão3 e hipertrofia26 ventricular esquerda, embora os dois esquemas de tratamento tenham reduzido de forma eficaz a pressão arterial23 nessa população de pacientes. No estudo LIFE, losartana potássica diminuiu o risco de morbidade31 e mortalidade32 cardiovasculares em comparação com o atenolol em pacientes hipertensos não negros com hipertrofia26 ventricular esquerda (n= 8.660) conforme medido pelo desfecho primário de incidência25 combinada de morte cardiovascular, acidente vascular cerebral33 e infarto do miocárdio34 (p= 0,003). Nesse estudo, entretanto, o risco de apresentar o desfecho primário composto foi menor em pacientes negros que receberam atenolol em comparação com os que receberam losartana potássica (p= 0,03). No subgrupo de pacientes negros (n= 533; 6% dos pacientes do estudo LIFE), ocorreram 29 desfechos primários entre os 263 pacientes do grupo do atenolol (11%, 25,9/1.000 pacientes-anos) e 46, entre os 270 pacientes (17%, 41,8/1.000 pacientes-anos) do grupo do losartana potássica.
Neste estudo, losartana potássica em geral foi bem tolerado. Seu perfil de tolerabilidade foi superior ao do atenolol, conforme evidenciado pela incidência25 significativamente mais baixa de descontinuações por efeitos adversos.
Estudo RENAAL: O estudo Reduction of Endpoints in NIDDM with the Angiotensin II Receptor Antagonist Losartan (RENAAL) foi um estudo mundial de grande porte, multicêntrico, randômico, controlado com placebo14 e duplo-cego que envolveu 1.513 pacientes com diabetes tipo 237 e proteinúria38 (751 receberam losartana potássica ), com ou sem hipertensão3. O objetivo do estudo foi demonstrar os efeitos protetores renais de losartana potássica acima e além dos benefícios do controle da pressão arterial23 apenas.
Para atingir esse objetivo, a meta da pressão arterial23 foi a mesma nos dois grupos de tratamento. Os pacientes com proteinúria38 e creatinina39 sérica entre 1,3 e 3,0 mg/dl40 foram distribuídos de modo randômico para receber 50 mg de losartana potássica uma vez ao dia, titulada de acordo com a resposta da pressão arterial23, ou placebo14, e terapia anti-hipertensiva convencional, excluindo-se inibidores da ECA e antagonistas da angiotensina II. Os pesquisadores foram orientados a titular o medicamento de estudo para 100 mg uma vez ao dia, conforme apropriado; 72% dos pacientes tomaram a dose diária de 100 mg durante a maioria do tempo em que receberam o medicamento de estudo. Em ambos os grupos, quando necessário, puderam ser adicionados outros agentes anti-hipertensivos (diuréticos24, bloquea-dores dos canais de cálcio, alfa- ou betabloqueadores e agentes de ação central). Os pacientes foram acompanhados por até 4,6 anos (média de 3,4 anos).
O desfecho primário do estudo foi o desfecho composto de duplicação da creatinina39 sérica, doença insuficiência renal41 terminal (necessidade de diálise42 ou transplante) ou morte. Os resultados mostraram que o tratamento com losartana potássica (327 eventos) em comparação com o placebo14 (359 eventos) resultou em redução do risco de 16,1% (p= 0,022) para os pacientes que atingiram o desfecho primário composto. Os resultados também demonstraram redução significativa do risco no grupo tratado com losartana potássica em relação aos seguintes componentes individuais e combinados do desfecho primário: 25,3% de redução do risco de duplicação da creatinina39 sérica (p= 0,006); 28,6% de redução do risco de insuficiência renal41 terminal (p= 0,002); 19,9% de redução do risco de insuficiência renal41 terminal ou morte (p= 0,009); 21,0% de redução do risco de duplicação da creatinina39 sérica ou de insuficiência renal41 terminal (p= 0,010). A taxa de morte por todas as causas não foi significativamente diferente entre os dois grupos de tratamento.
Os desfechos secundários do estudo foram: alteração da proteinúria38; taxa de progressão danefropatia e o composto de morbimortalidade de causas cardiovasculares (hospitalização por insuficiência cardíaca35, infarto do miocárdio34, revascularização, acidente vascular cerebral33, hospitalização por angina36 instável ou morte cardiovascular). Os resultados mostraram redução média de 34,3% do nível de proteinúria38 no grupo do losartana potássica (p< 0,001). O tratamento com losartana potássica reduziu a taxa de declínio da função renal20 durante a fase crônica do estudo em 13,9%, p= 0,003 (taxa média de declínio de 18,5%, p= 0,01) conforme medido pela recíproca da concentração sérica de creatinina39. Não houve diferença significativa entre o grupo que recebeu losartana potássica (247 eventos) e o grupo placebo14 (268 eventos) no desfecho composto de morbimortalidade cardiovascular, embora o estudo não tivesse poder para detectar este efeito.
Neste estudo, losartana potássica em geral foi bem tolerado conforme evidenciado pela incidência25 semelhante de descontinuações por efeitos adversos em comparação com o placebo14.
Estudos ELITE I e ELITE II: No estudo ELITE, com 48 semanas de duração, que envolveu 722 pacientes com insuficiência cardíaca35 (Classe II-IV da NYHA), não se observaram diferenças no desfecho primário de disfunção renal20 persistente entre os pacientes que receberam losartana potássica e os que receberam captopril. A observação não esperada do benefício superior de losartana potássica na redução do risco de morte em relação ao captopril, observada no estudo ELITE, não foi confirmada no estudo de sobrevida43 definitivo, ELITE II, descrito a seguir.
Em um estudo que envolveu pacientes com insuficiência cardíaca35, desenhado para avaliar prospectivamente a mortalidade32 (ELITE II), comparou-se um esquema contendo 50 mg de losartana potássica em dose única diária (dose inicial de 12,5 mg titulada para 25 mg e 50 mg 1x/dia) a um esquema contendo 50 mg de captopril 3x/dia (dose inicial de12,5 mg titulada para 25 mg e 50 mg 3x/dia).
Neste estudo (n= 3.152), pacientes com insuficiência cardíaca35 (Classe II-IV da NYHA) foram acompanhados durante dois anos aproximadamente (mediana de acompanhamento de 1,5 ano) para avaliar se losartana potássica era superior ao captopril na redução da mortalidade32 por todas as causas. O desfecho primário não mostrou diferença estatisticamente significativa entre losartana potássica e captopril na redução da mortalidade32 por todas as causas (17,7% para o losartana potássica e 15,9% para o captopril, p= 0,16). O desfecho secundário não mostrou diferença estatisticamente significativa na redução de morte súbita de origem cardíaca e/ou parada cardíaca com ressuscitação (9,0% para losartana potássica e 7,3% para captopril, p= 0,08). O desfecho terciário de mortalidade32 por todas as causas e/ou hospitalizações por todas as causas não mostrou diferenças estatisticamente significativas entre losartana potássica e captopril (47,7% para losartana potássica e 44,9% para captopril, p= 0,18). Em geral, os outros desfechos de morbidade31 e de mortalidade32, incluindo melhora da classe funcional de acordo com a classificação da NYHA, não foram diferentes entre os grupos de tratamento.
Nesses dois estudos clínicos controlados em pacientes com insuficiência cardíaca35, losartana potássica
em geral foi bem tolerado e seu perfil de tolerabilidade foi superior ao do captopril, conforme avaliado pela incidência25 significativamente mais baixa de descontinuações por efeitos adversos e incidência25 significativamente mais baixa de tosse.


