
REAÇÕES ADVERSAS LEVITRA
A vardenafila foi administrada a mais de 9.500 pacientes nos estudos clínicos realizados em todo o mundo (Posição: Março 2004). Em geral, a vardenafila apresentou boa tolerabilidade. As reações adversas observadas foram geralmente transitórias e de intensidade leve a moderada.
Ensaios clínicos1 controlados com placebo2
Quando a vardenafila foi administrada conforme recomendado nos estudos clínicos controlados por placebo2, observaram-se as seguintes reações adversas (Posição: Março 2004):

Todos os ensaios clínicos1
A lista das reações adversas manifestadas durante o tratamento foi determinada de acordo com algoritmos pré-definidos. Nas categorias de freqüência, as reações adversas foram incluídas quando ocorreram no dia da última administração ou no dia seguinte de acordo com o critério abaixo:
• Raro: notas 1-2: graves de acordo com os termos críticos da OMS, e não usual na ausência de terapia com a droga.
• Pouco freqüente: notas ≥ 3-9: importante para orientação, monitoramento e decisão de tratamento; notas ≥ 10 todos.
• Freqüente e muito freqüente: todos.
As seguintes reações adversas foram relatadas em pacientes tratados com vardenafila em todos os estudos clínicos realizados (Posição: Março 2004):
A tabela a seguir contém todas as reações adversas relatadas em todos os estudos clínicos realizados mundialmente, que correspondem aos termos críticos da OMS (merecem atenção especial pela possibilidade de associação com doenças graves) ou que podem ter outro tipo de relevância clínica:
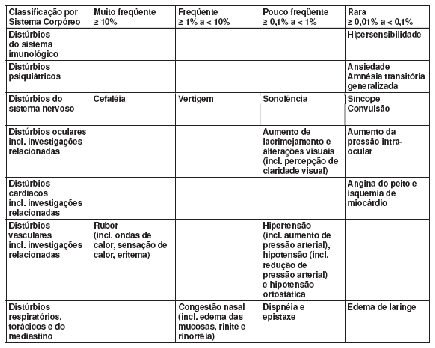
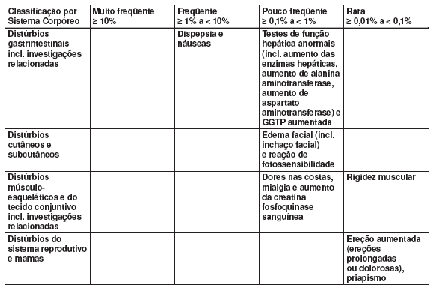
Pós-comercialização
Há relatos de infarto do miocárdio3 (IM) em associação temporal com o uso de vardenafila e a atividade sexual, mas não é possível determinar se o IM está diretamente relacionado à vardenafila, à atividade sexual, à doença cardiovascular subjacente do paciente ou à associação destes fatores.
Relataram-se raros casos pós-comercialização de neuropatia4 óptica isquêmica anterior não arterítica (NAION), uma causa de diminuição da visão5 com possível perda permanente da visão5, de relação temporal com o uso de inibidores da fosfodiesterase do tipo 5, inclusive de Levitra®. A maioria desses pacientes, mas não todos, apresentava fatores de risco subjacentes anatômicos ou vasculares6 para o desenvolvimento de NAION, incluindo baixa relação cup/disc (crowded disc), idade acima de 50 anos, diabetes7, hipertensão8, doença arterial coronariana, hiperlipidemia9 e tabagismo. Não é possível determinar se esses eventos estão diretamente relacionados ao uso de inibidores da PDE5, a pacientes com fatores de risco vasculares6 ou alterações anatômicas subjacentes ou a uma associação desses fatores, ou ainda a outros fatores.
Há raros relatos pós-comercialização de distúrbios visuais com perda da visão5 (temporária ou permanente) com relação temporal com o uso de inibidores da fosfodiesterase do tipo 5, inclusive de Levitra®. Não é possível determinar se esses eventos estão diretamente relacionados ao uso de inibidores da PDE5, a pacientes com fatores de risco vasculares6 subjacentes ou a outros fatores.
Surdez repentina ou perda de audição foram reportadas em um pequeno número de casos de estudos clínicos e de estudos de pós-comercialização com o uso de todos os inibidores de PDE5, inclusive Levitra®.
Não é possível determinar se esses eventos reportados estão diretamente relacionados ao uso de Levitra®, a fatores de risco subjacentes para perda da audição, a uma combinação destes fatores ou a outros fatores.


