
INFORMAÇÕES TÉCNICAS TOPIRAMATO
Propriedades Farmacodinâmicas
O topiramato é classificado como monossacarídeo sulfamato-substituído. Estudos eletrofisiológicos e bioquímicos em cultura de neurônios1 identificaram três propriedades que podem contribuir para a eficácia antiepiléptica do topiramato.
Potenciais de ação provocados repetidamente pela despolarização contínua de neurônios1 foram bloqueados temporariamente pelo topiramato, sugerindo uma modulação de canais de sódio dependentes de voltagem. O topiramato aumenta a frequência com que o ácido gama-aminobutírico (GABA2) ativa receptores GABA2 A e aumenta a capacidade do GABA2 de induzir o influxo de íons3 cloreto, sugerindo que o topiramato potencializa a atividade desse neurotransmissor inibitório.
Este efeito não foi bloqueado pelo flumazenil, um antagonista4 benzodiazepínico, e o topiramato não aumentou a duração da abertura do canal, o que o diferencia de barbitúricos que modulam receptores GABA2 A.
Como o perfil antiepiléptico do topiramato difere acentuadamente do das benzodiazepinas, ele pode modular um subtipo do receptor GABA2 A insensível à benzodiazepina. O topiramato antagoniza a capacidade do cainato ativar o subtipo AMPA/cainato (ácido a-amino-3-hidroxi-5-metilisoxazol-4-propiônico) do receptor aminoácido excitatório (glutamato), mas não exerce nenhum efeito aparente na atividade do N-metil-D-aspartato (NMDA) no subtipo de receptor NMDA. Estes efeitos do topiramato são dependentes da concentração, em uma faixa de 1 mM a 200 mM, com atividade mínima observada entre 1 mM e 10 mM. Além disso, o topiramato inibe algumas isoenzimas da anidrase carbônica. Este efeito farmacológico é muito mais fraco do que o da acetazolamida, um conhecido inibidor da anidrase carbônica, e não é considerado um componente importante da atividade antiepiléptica do topiramato.
Em estudos experimentais, o topiramato apresenta atividade anticonvulsivante em ratos e camundongos, em crises induzidas por eletrochoque máximo, e é eficaz em modelos de epilepsia5 em roedores, que incluem crises tônicas e crises semelhantes a crises de ausência, em ratos com epilepsia5 espontânea, e crises tônico-clônicas induzidas em ratos por abrasamento da amígdala6 ou isquemia7 global. O topiramato é apenas discretamente eficaz no bloqueio de crises clônicas induzidas pelo pentilenotetrazol, um antagonista4 de receptor GABA2 A.
Estudos realizados em camundongos submetidos a administração concomitante de topiramato e carbamazepina ou fenobarbital demonstraram atividade anticonvulsivante sinérgica, enquanto que a associação com fenitoína mostrou atividade anticonvulsivante aditiva. Em estudos clínicos bem controlados de uso adjuvante, não foi verificada nenhuma correlação entre concentrações plasmáticas de vale do topiramato e sua eficácia clínica. Não há evidência de tolerância em humanos.
Os resultados de experimentações clínicas controladas estabeleceram a eficácia de topiramato como monoterapia para adultos e crianças (de 6 anos de idade ou mais velhos) com epilepsia5, terapia adjuntiva em adulto e pacientes pediátricos de 2 a 16 anos com crises epilépticas parciais e crises convulsivas tônico-clônicas generalizadas primárias, e nos pacientes com 2 anos de idade e mais velhos com crises associadas com a Sindrome8 de Lennox-Gastaut.
Monoterapia
A efetividade do topiramato como monoterapia em adultos e em crianças de 6 anos de idade e mais velhos com epilepsia5 recentemente diagnosticada foi estabelecida em 4 estudos randomizados, duplo-cego, e paralelos. O estudo EPMN-106 foi conduzido em 487 pacientes (6 a 83 anos de idade) que tiveram um diagnóstico9 novo de epilepsia5 (de início parcial ou generalizado) ou um diagnóstico9 de epilepsia5 recorrente enquanto não estavam fazendo uso de drogas antiepiléticas (AEDs). Os pacientes foram randomizados para receber o topiramato 50 mg/dia ou o topiramato 400 mg/dia. Os pacientes permaneceram na fase duplo-cego até apresentarem a primeira crise parcial ou crise tônico-clônica generalizada, até o término da fase de duplo-cego 6 meses após a randomização do último sujeito, ou até a retirada por razões específicas do protocolo. A avaliação primária de eficácia foi baseada na comparação entre grupos de dose do topiramato com respeito ao tempo para a primeira crise parcial ou crise generalizada tônico-clônica durante a fase duplo-cega. A comparação das curvas da sobrevivência10 de Kaplan-Meier do tempo para a primeira crise favoreceu a topiramato 400 mg/dia sobre o topiramato 50 mg/dia (p=0.0002, teste log-rank). A separação entre os grupos em favor do grupo de maior dose ocorreu precocemente na fase de titulação e foi estatisticamente significativa tão precocemente quanto duas semanas pós randomização (p=0,046), quando, seguindo a programação semanal de titulação, os sujeitos no grupo de maior dose alcançaram uma dose máxima do topiramato de 100 mg/dia. O grupo de maior dose também foi superior ao do grupo com menor dose com respeito à proporção dos sujeitos que remanesceram sem crise convulsiva, baseado nas estimativas de Kaplan-Meier, para um mínimo de 6 meses da terapia (82,9% contra 71,4%; p=0,005), e para um mínimo de 1 ano da terapia (75,7% contra 58,8%; p=0,001). A relação de taxas de falha por tempo até a primeira crise convulsiva foi 0,516 (intervalo da confiança de 95%, 0,364 a 0,733). Os efeitos do tratamento com respeito ao tempo até a primeira crise convulsiva foi consistente através dos vários subgrupos definidos pela idade, sexo, região geográfica, peso corpóreo basal, tipo de crise convulsiva basal, tempo desde o diagnóstico9 e uso de anticoncepcionais basais.
No estudo YI, estudo de centro único, pacientes com idades 15-63 anos com crise convulsiva refratária parcial (n=48) foram convertidos de seu tratamento prévio para monoterapia com topiramato 100 mg/dia ou 1000 mg/dia. O grupo de alta dose foi estatisticamente superior ao grupo de menor dose para as variáveis de eficácia. 54% dos pacientes de alta dose conseguiram monoterapia comparado à 17% do grupo de baixa dose com a diferença entre as doses sendo estatisticamente significativa (p=0,005). O tempo médio de retirada foi significativamente maior no grupo de alta dose (p=0,002). As avaliações globais do investigador e do sujeito da resposta clínica favoreceram estatisticamente o grupo de alta dose (≤0,002).
No estudo EPMN-104, pacientes adultos e pediatricos (de idades 6-85 anos) com epilepsia5 recentemente diagnosticada (n=252) foram randomizados em grupos de baixas-doses (25 ou 50 mg/dia) ou alta dose (200 ou 500 mg/dia) baseado em seu peso corpóreo. No geral, 54% dos pacientes do grupo de alta dose e 39% dos pacientes de baixa dose relataram estar sem crise convulsiva durante a fase duplo-cego (p=0,022). O grupo de alta dose também foi superior ao grupo de baixa dose com respeito à distribuição de freqüência das crises convulsivas (p=0,008) e à diferença no tempo até a primeira crise convulsiva através de três concentrações plasmáticas estratificadas do topiramato (p=0,015).
No estudo EPMN-105, os pacientes com idade de 6-84 anos com epilepsia5 recentemente diagnosticada (n=613) foram randomizados para receber 100 ou 200 mg/dia de topiramato ou do tratamento antiepiléptico padrão (carbamazepina ou valproato). Topiramato foi tão eficaz quanto a carbamazepina ou o valproato na redução das crises convulsivas nestes pacientes; - o intervalo de confiança de 95% para a diferença entre os dois grupos do tratamento foram estreito e incluíram zero, indicando que não houve diferença estatisticamente significativa entre os grupos. Os dois grupos de tratamento foram também comparáveis em relação a toda utilidade clínica e desfechos de eficácia incluindo tempo de retirada, proporção de indivíduos livres de crises convulsivas e tempo até a primeira crise convulsiva.
Pacientes (n=207; 32 com idade ≤ 16 anos) que completaram a fase duplo-cego do estudo YI e EPMN-104 foram inseridos na extensão a longo prazo do estudo com a maioria dos pacientes recebendo topiramato por 2 a 5 anos.
Nestes estudos, a eficácia mantida foi demonstrada com administração a longo prazo de topiramato como monoterapia. Não houve mudança significativa na dose durante o período de extensão e nenhuma indicação que a efetividade da monoterapia de topiramato diminuiu com exposição continuada.
Terapia Adjuntiva
Estudo controlado em pacientes com Crises Convulsivas de Início Parcial
Os adultos com Crises Convulsivas de Início Parcial
A eficácia do topiramato como um tratamento adjuntivo para adultos com Crises Convulsivas de Início Parcial foi estabelecida em seis estudos multicêntricos, randomizados, duplo-cego, controlados por placebo11, dois comparando diversas dosagens do topiramato e do placebo11 e quatro comparando uma única dosagem com placebo11 em pacientes com um histórico de Crises Convulsivas de Início Parcial, com ou sem generalização secundária dessas crises.
Foi permitido aos pacientes destes estudos um máximo de duas drogas antiepilépticas (AEDs) em adição às cápsulas de topiramato ou placebo11. Em cada estudo, os pacientes foram estabilizados em dosagens ótimas de seus concomitantes AEDs durante a fase basal que durou entre 4 e 12 semanas. Os pacientes que experimentaram um número mínimo pré-especificado de Crises Convulsivas de Início Parcial, com ou sem generalização secundária, durante a fase basal (12 apreensões para a fase 12-semanas, 8 para a fase basal 8-semanas, ou 3 para a fase basal de 4-semanas) foram atribuídos de forma randomizada ao placebo11 ou a uma dose especifica de topiramato cápsulas além do seu outro antiepiléptico.
Após a randomização, os pacientes começaram a fase duplo-cego do tratamento. Em cinco dos seis estudos, os pacientes receberam a droga ativa começando com 100 mg por dia; a dose foi então aumentada por incrementos de 100 ou 200 mg/dia semanalmente ou semanas alternadas até que a dose determinada fosse atingida, a menos que a intolerância impedisse os aumentos. No sexto estudo (119), os 25 ou 50 mg/dia de doses iniciais do topiramato foram seguidas por aumentos semanais respectivos de 25 ou 50 mg/dia até que a dose alvo de 200 mg/dia fosse atingida.
Após a titulação, os pacientes entraram no período de 4, 8, ou 12-semanas de estabilização. Os números de pacientes randomizados para cada dose, e as doses medianas e médias reais de estabilização são mostradas na Tabela 1.
Pacientes Pediátricos com idade de 2-16 anos com Crises Convulsivas de Início Parcial
A efetividade do topiramato enquanto um tratamento adjuntivo para pacientes12 pediátricos de 2-16 anos com Crises Convulsivas de Início Parcial foram estabelecidos em um estudo multicêntrico, randomizado13, duplo-cego, controlado por placebo11, comparando topiramato e o placebo11 nos pacientes com uma historia de Crises Convulsivas de Início Parcial com ou sem generalização secundária dessas crises.
Foi permitido aos pacientes destes estudos um máximo de duas drogas antiepilépticas (AEDs) além das cápsulas de topiramato ou placebo11. Neste estudo, os pacientes foram estabilizados em dosagens ótimas de seus antiepilépticos concomitantes durante a fase basal de 8 semanas. Os pacientes que experimentaram ao menos seis Crises Convulsivas de Início Parcial, com ou sem generalização secundária, durante a fase basal foram atribuídos de forma randomizada ao
placebo11 ou topiramato comprimidos em adição ao seu outro AEDs.
Após a randomização, os pacientes começaram a fase duplo-cega do tratamento. Os pacientes receberam a droga ativa começando com 25 ou 50 mg por dia; a dose foi então aumentada em 25 a 150 mg/dia em semanas alternadas até que a dose de 125, 175, 225 ou 400 mg/dia baseada no peso do paciente e aproximada a uma dose de 6 mg/kg fosse atingida, a menos que a intolerância impedisse os aumentos. Após a titulação, os pacientes entraram no período de 8 semanas de estabilização.
Estudo controlado em pacientes com Crise Convulsiva Tônico-Clônica Generalizada Primária
A eficácia do topiramato como um tratamento adjuntivo para Crise Convulsiva Tônico-Clônica Generalizada Primária nos pacientes de 2 anos de idade ou mais velhos foi estabelecida em um estudo multicêntrico, randomizado13, duplo-cego, controlado por placebo11, comparando uma única dosagem do topiramato e do placebo11.
Foi permitido aos pacientes destes estudos um máximo de duas drogas antiepilépticas (AEDs) além do topiramato ou placebo11. Neste estudo, os pacientes foram estabilizados em dosagens ótimas de seus antiepilépticos concomitantes durante uma fase de 8 semanas. Os pacientes que experimentaram pelo menos três Crise Convulsiva Tônico-Clônica Generalizada Primária durante a fase basal foram atribuídos de forma randomizada ao placebo11 ou topiramato cápsulas além do seu outro AEDs.
Após a randomização, os pacientes começaram a fase duplo-cega do tratamento. Os pacientes receberam a droga ativa começando com 50 mg por dia por quatro semanas; a dose foi então aumentada em 50 a 150 mg/dia em semanas alternadas até que a dose de 175, 225 ou 400 mg/dia baseada no peso do paciente e aproximada a uma dose de 6 mg/kg fosse atingida, a menos que a intolerância impedisse os aumentos. Após a titulação, os pacientes entraram no período de 12-semanas de estabilização.
Estudos controlados em pacientes com Síndrome8 de Lennox-Gastaut
A eficácia do topiramato como um tratamento adjuntivo para crises associadas com a Síndrome8 de Lennox-Gastaut foi estabelecida em um estudo multicêntrico, randomizado13, duplo-cego, controladas por placebo11, comparando uma única dosagem do topiramato com o placebo11 em pacientes de dois anos de idade ou mais velhos.
Foi permitido aos pacientes destes estudos um máximo de duas drogas antiepilépticas (AEDs) além das cápsulas de topiramato ou placebo11. Pacientes que haviam apresentado pelo menos 60 crises por mês antes de iniciarem o estudo foram estabilizados em dosagens ótimas de seus concomitantes AEDs durante a fase basal de quatro semanas.
Acabando a fase basal, os pacientes foram atribuídos de forma randomizada ao placebo11 ou topiramato cápsulas além do seu outro AEDs.
A droga ativa foi titulada começando a 1 mg/kg por dia por semana; a dose foi então aumentada por incrementos de 3 mg/dia por uma semana e depois de 6 mg/kg por dia. Após a titulação, os pacientes entraram no período de 8-semanas de estabilização. As medidas preliminares de efetividade foram a redução da porcentagem de drop attack e uma avaliação global parental da severidade da crise convulsiva. Em todos os estudos add-on, foi medida a redução na taxa de crise convulsiva da condição basal durante a fase duplo-cego.
As reduções percentuais medianas nas taxas de crise convulsiva e nas taxas de respondedores (fração dos pacientes com ao menos uma redução de 50%) por grupo de tratamento para cada estudo são mostradas abaixo na Tabela 1. Como descrito acima, uma melhora global na severidade da crise convulsiva foi avaliada também na experimentação de Lennox-Gastaut.
Tabela 1: Resultados de Eficácia em estudo duplo-cego14, placebo11-controlado, add-on de crises epilépticas.
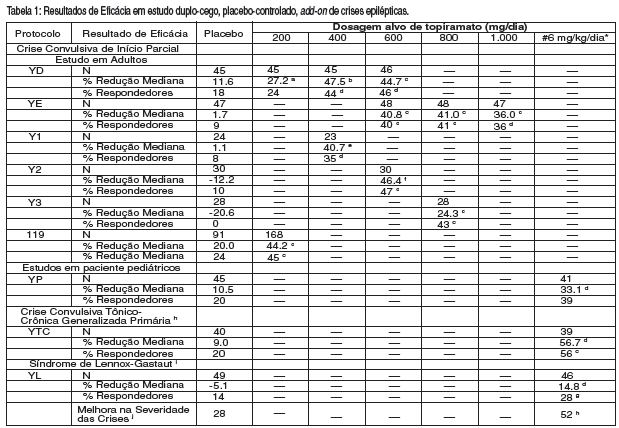
Comparação com o placebo11: a p=0.080; b p≤0.010; c p≤0.001; d p≤0.050; e p=0.065; f p≤0.005; g p=0.071; h% Redução Mediana e % respondedores são relatadas por Crise Convulsiva Tônico-Clônica Generalizada; i % Redução Mediana e % respondedores são relatadas para drop attack, i.e., crise tônica ou atônica; j Porcentagem de indivíduos que apresentaram melhora mínima, muita ou muito melhor a partir da linha de base.
* Para os protocolos YP e o YTC , dosagens alvo especificadas no protocolo (<9,3 mg/kg/dia) foram baseados no peso do indivíduo para aproximar a de 6 mg/kg por dia, esta dosagem corresponde a dosagem em mg/dia de 125, 175, 225, e 400 mg/dia.
As análises do subconjunto da eficácia antiepiléptica do topiramato nos estudos não mostraram diferença em função do gênero, raça, idade, taxa basal de crise convulsiva, ou da antiepiléptico concomitante.
Propriedades Farmacocinéticas
As formulações em comprimido e cápsula são bioequivalentes.
Em comparação a outras drogas antiepilépticas, o topiramato apresenta uma meia-vida plasmática longa, farmacocinética linear, depuração plasmática predominantemente renal15, ausência de ligação significante a proteínas16 plasmáticas e de metabólitos17 ativos significantes.
O topiramato não é um indutor potente de enzimas relacionadas à biotransformação de fármacos, pode ser administrado com ou sem alimentos e não requer monitorização de níveis plasmáticos. Em ensaios clínicos18, não houve relação consistente entre concentrações plasmáticas e eficácia ou eventos adversos.
O topiramato é rapidamente e bem absorvido. Após a administração oral de 100 mg de topiramato a voluntários sadios, o pico médio de concentração plasmática (Cmáx) foi de 1,5 Ïg/mL, obtido num período de 2 a 3 horas (Tmáx). Com base na recuperação da radioatividade na urina19, a extensão média de absorção de uma dose oral de 100 mg de topiramato marcado com 14C foi de, no mínimo, 81%. A biodisponibilidade do topiramato não é afetada de forma clinicamente significante pela ingestão de alimentos. A ligação a proteínas16 plasmáticas é, em geral, de 13 a 17%. Observa-se baixa capacidade de ligação do topiramato aos eritrócitos20, saturável em concentrações plasmáticas acima de 4 mg/mL. O volume de distribuição variou de forma inversamente proporcional à dose. A média do volume de distribuição aparente foi de 0,80 a 0,55 L/kg, para uma única dose entre 100 a 1.200 mg. Um efeito do gênero sobre o volume de distribuição foi detectado, com valores em mulheres cerca de 50% dos obtidos em homens. Esta diferença foi atribuída à maior porcentagem de gordura21 corpórea em pacientes do sexo feminino, sem conseqüência clínica.
Em voluntários sadios, o topiramato não sofre biotransformação extensa (aproximadamente 20%). É biotransformado em até 50% em uso adjuvante com indutores reconhecidos de enzimas relacionadas à biotransformação de fármacos.
Seis metabólitos17, formados por hidroxilação, hidrólise e glucuronidação, foram identificados, caracterizados e isolados no plasma22, urina19 e fezes. Cada metabólito23 representa menos de 3% da radioatividade total excretada após a administração do topiramato marcado com 14C. Dois metabólitos17, que conservam a maior parte da estrutura química do topiramato, foram testados e apresentaram pouca ou nenhuma atividade anticonvulsivante.
Em humanos, a principal via de eliminação do topiramato inalterado e de seus metabólitos17 é a renal15 (no mínimo 81% da dose).
Aproximadamente 66% de uma dose de topiramato marcado com 14C foi excretada inalterada na urina19, em quatro dias.
Após a administração de doses de 50 mg e 100 mg de topiramato, duas vezes ao dia, a depuração renal15 média foi de aproximadamente 18 mL/min e 17 mL/min, respectivamente. Há evidência de reabsorção tubular renal15 do topiramato.
Este achado é comprovado por estudos conduzidos em ratos, onde o topiramato associado à probenecida, tendo sido observado um aumento significante da depuração renal15 do topiramato. De modo geral, a depuração plasmática do topiramato em humanos é de aproximadamente 20 a 30 mL/min, após a administração oral.
O topiramato apresenta baixa variação interindividual nas concentrações plasmáticas e, portanto, apresenta farmacocinética previsível. A farmacocinética do topiramato é linear, com a depuração plasmática permanecendo constante e a área sob a curva de concentração plasmática aumentando de modo proporcional a doses orais, em uma faixa posológica de 100 a 400 mg, em voluntários sadios. Pacientes com função renal15 normal podem levar 4 a 8 dias para atingir as concentrações plasmáticas do estado de equilíbrio. Após a administração de doses orais múltiplas de 100 mg, duas vezes ao dia, a voluntários sadios, a Cmáx média foi de 6,76 mcg/mL. A meia-vida de eliminação plasmática após a administração de doses múltiplas de 50 mg e 100 mg, duas vezes ao dia, foi de aproximadamente 21 horas.
O uso adjuvante de topiramato, em doses múltiplas de 100 a 400 mg, duas vezes por dia, com fenitoína ou carbamazepina, produz aumentos proporcionais à dose nas concentrações plasmáticas do topiramato.
A depuração plasmática e renal15 do topiramato é reduzida em pacientes com insuficiência renal24 (CLCR ≤ 60 mL/min). Em pacientes com doença renal15 grave, a depuração plasmática apresentou-se reduzida. Como resultado, concentrações plasmáticas de equilíbrio mais elevadas são esperadas para uma determinada dose de topiramato administrada, a pacientes com insuficiência renal24, em comparação às obtidas em pacientes com função renal15 normal. O topiramato pode ser removido do plasma22, com eficácia, por hemodiálise25.
A depuração plasmática do topiramato permanece inalterada em indivíduos idosos, na ausência de doença renal15 subjacente.
A depuração plasmática do topiramato é reduzida em pacientes com insuficiência hepática26 moderada ou grave.
Farmacocinética em crianças de até 12 anos de idade
A farmacocinética do topiramato em uso adjuvante é linear em crianças, como em adultos, com taxa de depuração independente da dose e concentrações plasmáticas de equilíbrio com aumentos proporcionais à dose. No entanto, crianças têm depuração mais elevada e meia-vida de eliminação mais curta. Consequentemente, concentrações plasmáticas de topiramato para a mesma dose em mg/kg podem ser menores em crianças comparadas às obtidas em adultos. Assim como em adultos, drogas antiepilépticas indutoras de enzimas hepáticas27 diminuem as concentrações plasmáticas do estado de equilíbrio.
- INDICAÇÕES
Topiramato é indicado em monoterapia tanto em pacientes com epilepsia5 recentemente diagnosticada como em pacientes que recebiam terapia adjuvante e serão convertidos à monoterapia.
Topiramato é indicado, para adultos e crianças, como adjuvante no tratamento de crises epilépticas parciais, com ou sem generalização secundária e crises tônico-clônica generalizadas primárias.
Topiramato é indicado, também, para adultos e crianças como tratamento adjuvante das crises associadas à Síndrome8 de Lennox-Gastaut.
Topiramato é indicado, em adultos, como tratamento profilático da enxaqueca28. O uso de topiramato para o tratamento agudo29 da enxaqueca28 não foi estudado.


