ESTUDOS EM MONOTERAPIA EM EPILEPSIA TOPIRAMATO
EM GERAL, OS EVENTOS ADVERSOS OBSERVADOS EM ESTUDOS EM MONOTERAPIA FORAM QUALITATIVAMENTE SIMILARES AOS OBSERVADOS DURANTE OS ESTUDOS EM TERAPIA ADJUVANTE. COM EXCEÇÃO DE PARESTESIA1 E FADIGA2, ESTES EVENTOS ADVERSOS FORAM RELATADOS COM INCIDÊNCIA3 SIMILAR OU MENOR QUE NOS ESTUDOS EM MONOTERAPIA.
PACIENTES ADULTOS
EM ESTUDOS CLÍNICOS DUPLO-CEGOS, OS EVENTOS ADVERSOS CLINICAMENTE RELEVANTES OCORRENDO COM INCIDÊNCIA3 MAIOR OU IGUAL A 10% EM PACIENTES ADULTOS TRATADOS COM TOPIRAMATO INCLUÍRAM: PARESTESIA1, CEFALÉIA4, TONTURA5, FADIGA2, SONOLÊNCIA, PERDA DE PESO, NÁUSEA6 E ANOREXIA7.
PACIENTES PEDIÁTRICOS
EM ESTUDOS CLÍNICOS DUPLO-CEGOS, OS EVENTOS ADVERSOS CLINICAMENTE RELEVANTES OCORRENDO COM INCIDÊNCIA3 MAIOR OU IGUAL A 10% NOS PACIENTES PEDIÁTRICOS TRATADOS COM TOPIRAMATO FORAM: CEFALÉIA4, FADIGA2, ANOREXIA7 E SONOLÊNCIA.
ENXAQUECA8
EM ESTUDOS DUPLO-CEGOS, EVENTOS ADVERSOS CLINICAMENTE RELEVANTES QUE OCORRERAM COM FREQUÊNCIA MAIOR OU IGUAL A 5% E FORAM OBSERVADOS COM INCIDÊNCIA3 MAIOR EM PACIENTES TRATADOS COM TOPIRAMATO DO QUE COM PLACEBO9 INCLUÍRAM: FADIGA2, PARESTESIA1, TONTURA5, HIPOESTESIA10, PROBLEMAS DE LINGUAGEM, NÁUSEA6, DIARRÉIA11, DISPEPSIA12, DEPRESSÃO, PERVERSÃO DO PALADAR13, VISÃO14 ANORMAL.
PACIENTES TRATADOS COM TOPIRAMATO APRESENTARAM ALTERAÇÃO PERCENTUAL MÉDIA DO PESO CORPORAL DEPENDENTE DA DOSE. ESTA ALTERAÇÃO NÃO FOI OBSERVADA NO GRUPO PLACEBO9. ALTERAÇÕES MÉDIAS DE 0,0; -2,3%; -3,2% E -3,8% FORAM OBSERVADAS NOS GRUPOS PLACEBO9, TOPIRAMATO 50 MG, 100 MG E 200 MG RESPECTIVAMENTE.
EXPERIÊNCIA PÓS-COMERCIALIZAÇÃO E OUTRAS EXPERIÊNCIAS
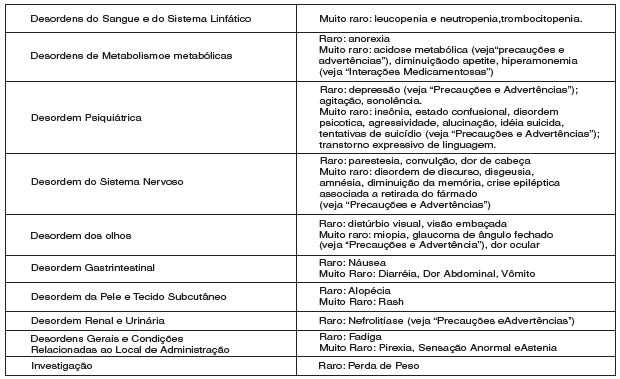
AS REAÇÕES ADVERSAS A DROGA ORIGINADAS DOS RELATÓRIOS ESPONTÂNEOS DURANTE A EXPERIÊNCIA PÓS-COMERCIALIZAÇÃO MUNDIAL COM TOPIRAMATO ESTÃO INCLUÍDAS NA TABELA ABAIXO. AS REAÇÕES ADVERSAS DA DROGA ESTÃO ORDENADAS POR FREQUÊNCIA, USANDO A SEGUINTE CONVENÇÃO (TODAS CALCULADAS POR PACIENTE-ANO DA EXPOSIÇÃO ESTIMADA)

AS FREQUÊNCIAS MENCIONADAS ABAIXO REFLETEM AS TAXAS DE RELATO PARA REAÇÕES ADVERSAS A DROGA DOS RELATÓRIOS ESPONTÂNEOS, E NÃO REPRESENTAM UMA ESTIMATIVA MAIS PRECISA DE QUE PODEM SER OBTIDAS EM ESTUDOS CLÍNICOS OU EXPERIMENTAIS.
RELATOS ISOLADOS DE HEPATITE15 E INSUFICIÊNCIA HEPÁTICA16 TÊM OCORRIDO EM PACIENTES EM USO DE MÚLTIPLOS MEDICAMENTOS DURANTE O TRATAMENTO COM TOPIRAMATO.
RELATOS ISOLADOS DE ERUPÇÕES BOLHOSAS E LESÕES17 EM MUCOSAS18 (INCLUINDO ERITEMA MULTIFORME19, PÊNFIGO, SÍNDROME DE STEVENS-JOHNSON20 E NECRÓLISE EPIDÉRMICA TÓXICA21) TAMBÉM TÊM OCORRIDO.
A MAIORIA DESTES RELATOS OCORREU EM PACIENTES EM USO DE OUTROS MEDICAMENTOS TAMBÉM ASSOCIADOS A ERUPÇÕES BOLHOSAS E LESÕES17 EM MUCOSAS18.
OLIGOIDROSE TEM SIDO RARAMENTE RELATADA COM O USO DE TOPIRAMATO. A MAIORIA DESTES RELATOS OCORREU EM CRIANÇAS.
RELATOS PÓS-COMERCIALIZAÇÃO DE REAÇÕES ADVERSAS A DROGA