
INFORMAÇÕES AO PACIENTE FUZEON
Solicitamos a gentileza de ler cuidadosamente as informações abaixo. Caso não esteja seguro a respeito de determinado item, favor informar ao seu médico.
1. AÇÃO DO MEDICAMENTO
Enfuvirtida é o primeiro membro de classe terapêutica1 chamada inibidor de fusão. É um inibidor do rearranjo estrutural da gp41 do HIV2 que se liga especificamente à proteína gp 41 do vírus3 HIV2 bloqueando a entrada do vírus3 na célula4. Enfuvirtida não requer ativação intracelular. A atividade antiviral da enfuvirtida resulta de sua associação com a região HR1 da gp 41 do HIV2 na superfície viral.
2. INDICAÇÕES DO MEDICAMENTO
Fuzeon® é indicado para o tratamento da infecção5 por HIV2-1 em combinação com outros agentes anti-retrovirais em pacientes com tratamento prévio e com evidência de replicação do HIV2-1 a despeito da terapia anti-retroviral. Não há estudos sobre o uso de Fuzeon® em pacientes virgens de tratamento anti-retroviral.
3. RISCOS DO MEDICAMENTO
Contra-indicações
Fuzeon® está contra-indicado em pacientes com hipersensibilidade conhecida à enfuvirtida ou a qualquer um de seus componentes. Os pacientes que desenvolvam sinais6 ou sintomas7 sugestivos de reação de hipersensibilidade devem descontinuar o tratamento com Fuzeon® e procurar avaliação médica imediatamente.
Cada frasco e cada seringa8 devem ser usados uma única vez, sendo que as porções não utilizadas devem ser eliminadas. Não é permitido misturar qualquer outra substância à solução com Fuzeon® para ser injetado conjuntamente. Informe seu médico sobre qualquer medicamento que esteja usando antes do início ou durante o tratamento. Foram relacionados com um risco maior de pneumonia9 bacteriana os usuários de drogas intravenosas, os fumantes, os pacientes com história de doença pulmonar prévia e aqueles com um baixo número inicial de linfócitos CD4. Estes grupos de pacientes devem ser acompanhados de perto pelo médico, caso apresentem sinais6 e sintomas7 sugestivos de pneumonia9.
NÃO TOME REMÉDIO SEM O CONHECIMENTO DO SEU MÉDICO. PODE SER PERIGOSO PARA A SAÚDE10.
Advertências
Um pequeno número de casos de reações de hipersensibilidade sistêmica foi associado à terapia com Fuzeon®: rubor, febre11, náuseas12, vômitos13, calafrios14, tremores, hipotensão15, elevação de enzimas hepáticas16, reação primária de imunocomplexos17, distúrbio respiratório e glomerulonefrite18. Houve o relato de um caso de Síndrome19 de Guillain-Barré observado nos estudos clínicos. Os pacientes devem ser orientados a descontinuar o tratamento com Fuzeon® e procurar avaliação médica imediatamente, caso desenvolvam sinais6 ou sintomas7 sugestivos de reação de hipersensibilidade. A terapia com Fuzeon® não deve ser reiniciada após sinais6 e sintomas7 consistentes com uma reação de hipersensibilidade relacionada ao uso de Fuzeon®. Observou-se uma incidência20 aumentada de pneumonia9 bacteriana, algumas vezes fatal, nos estudos clínicos em pacientes tratados com Fuzeon®. Os pacientes devem ser monitorados quanto a sinais6 e sintomas7 de infecção5, especialmente se apresentarem os seguintes fatores de risco: baixa contagem inicial de linfócitos CD4, elevada carga viral inicial, uso de drogas intravenosas, tabagismo e história pulmonar prévia. A administração de Fuzeon® a indivíduos não infectados (em profilaxia pósexposição, por exemplo) pode induzir à formação de anticorpos21 antienfuvirtida que reagem de forma cruzada com a gp41 do HIV2. Isto pode resultar em falso positivo em teste anti-HIV2 ELISA.
Síndrome19 da reconstituição imune (também conhecida como Síndrome19 da reativação imune, Doença da restauração imune ou Síndrome19 da inflamação22 reconstituição imune): Síndrome19 da reconstituição imune tem sido relatada em pacientes tratados com terapia anti-retroviral combinada, incluindo Fuzeon®. Durante a fase inicial do tratamento antiretroviral em combinação, pacientes com sistema imunológico23 responsivo podem desenvolver uma resposta inflamatória a infecções24 oportunistas residuais ou indolentes (tais como infecção5 por Mycobaterium avium, citomegalovirus25, pneumonia9 por Pneumocystis jirovecii [PCP], tuberculose26 ou outras) e podem necessitar de avaliação e tratamento imediatos.
O paciente deve ser sempre bem orientado quanto aos: cuidados e manuseio correto de seringas e agulhas; sobre a importância do descarte destes materiais no recipiente adequado e sobre o local de retorno deste recipiente para que o mesmo seja submetido à destruição adequada.
Os materiais do kit e o recipiente de descarte sempre devem ser mantidos fora do alcance das crianças.
Caso alguma outra pessoa auxilie o paciente a aplicar a medicação, esta deve ser orientada a utilizar luvas e a procurar serviço médico imediatamente caso sofra algum acidente com material pérfuro-cortante.
Principais interações medicamentosas
Com base nos resultados de um estudo microssomal humano in vitro, Fuzeon® não é um inibidor das enzimas CYP450 e, portanto, não alterará o metabolismo27 das drogas metabolizadas pelas enzimas CYP450. Em um estudo do metabolismo27 humano in vivo, Fuzeon®, na dose recomendada de 90 mg duas vezes ao dia, não inibe o metabolismo27 de substratos pelo CYP3A4 (dapsona), CYP2D6 (debrisoquina), CYP1A2 (cafeína), CYP2C19 (mefentoína) e CYP2E1 (clorzoxazona). Em estudos isolados de interação farmacocinética, as co-administrações de ritonavir, saquinavir e rifampicina, não resultaram em interações farmacocinéticas clinicamente significantes com Fuzeon®.
Gravidez28 e amamentação29
Informe ao seu médico a ocorrência de gravidez28 na vigência do tratamento ou após seu término. Informe ao médico se está amamentando. Você não deverá amamentar durante o tratamento com Fuzeon®.
Não há, até o momento, estudos adequados e controlados em mulheres grávidas, portanto Fuzeon® só deverá ser usado durante a gravidez28 se o benefício potencial justificar o risco ao feto30.
Este medicamento não deve ser utilizado por mulheres grávidas ou que estejam amamentando sem orientação médica ou do cirurgião-dentista.
Efeitos sobre a capacidade de dirigir e operar máquinas, quando for o caso.
Não foram realizados estudos sobre a capacidade de dirigir veículos ou de operar máquinas durante a administração de Fuzeon®. Não há evidências de que Fuzeon® possa alterar a capacidade dos pacientes para dirigir veículos e de usar máquinas, porém, o perfil de eventos adversos de Fuzeon® deve ser levado em conta (Tabela 6).
Não existem dados que estabeleçam dose de Fuzeon® em crianças menores de 6 anos de idade.
Informe ao médico ou cirurgião-dentista o aparecimento de reações indesejáveis.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde10.
4. MODO DE USO
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Recomenda-se que a primeira injeção subcutânea31 ocorra sob a supervisão de um profissional de saúde10 devidamente qualificado. Um profissional de saúde10 deverá reavaliar periodicamente se os procedimentos estão sendo feitos corretamente.
Fuzeon® é fornecido em pó liofilizado32, que precisa ser reconstituído em solução com água estéril para injeção33. Todos os componentes necessários à injeção33 de Fuzeon® são fornecidos em um kit:
• 60 frascos de Fuzeon® (frasco com o pó branco)
• 60 frascos de água estéril para injeção33 (frasco com líquido transparente)
• Chumaços embebidos em álcool
• 60 seringas de 3 mL (para preparar a solução)
• 60 seringas de 1 mL (para a injeção subcutânea31)
• Recipiente para descarte de seringas
Preparação
• Aspiração da água para injeção33
As mãos34 devem ser lavadas com água e sabão antes que os frascos sejam preparados. Devem ser usadas luvas descartáveis se outra pessoa estiver aplicando a droga ao paciente. Se Fuzeon® estiver sendo armazenado em geladeira, retire-o junto com a ampola de água para injeção33 e aguarde até que atinjam a temperatura ambiente. Após retirar as tampas plásticas dos frascos de Fuzeon® e de água, faça antissepsia nas tampas de borracha de cada frasco com o chumaço embebido em álcool fornecido e deixe secar naturalmente.
Retire a água estéril com a seringa8 de 3 mL:
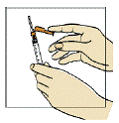
Figura 1
Pegue a seringa8 maior de 3 mL. Usando o dedo indicador, empurre para trás o protetor colorido da agulha em direção à seringa8 (figura 1).
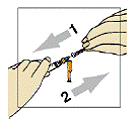
Figura 2
Para remover a capa plástica incolor da agulha, empurre-a e puxe-a sem fazer muita força (figura 2).
É preciso tomar cuidado durante os passos seguintes para garantir que não se formem bolhas na solução e que não fique ar retido na seringa8 antes da injeção33
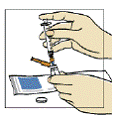
Figura 3
Inicialmente aspire 1,1 mL de ar com a seringa8 de 3 mL. Introduza a agulha da seringa8 na tampa de borracha do frasco de água para injeção33 e aperte o êmbolo35 para injetar o ar da seringa8 (figura 3).
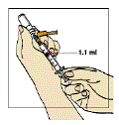
Figura 4
Vire o frasco de água para baixo, mantendo a ponta da agulha abaixo do nível da água. Puxe o êmbolo35 de volta lentamente até que a água chegue um pouco além da marca de 1,1 mL.
ATENÇÃO: O frasco contém 2 mL, ou seja, mais água do que a quantidade necessária para a diluição. Você só deve aspirar 1,1 mL do frasco, para que a medicação seja preparada adequadamente (figura 4).
Bata levemente na seringa8 para fazer com que bolhas de ar, eventualmente presentes, subam para a superfície. Aperte suavemente o êmbolo35 para expelir o ar e certifique-se de que exatamente 1,1 mL de água estéril fique na seringa8.
Retire a agulha do frasco, tomando cuidado para não encostar a agulha nos dedos ou em qualquer outro objeto. Descarte o frasco de água com o restante que não foi aspirado. A ÁGUA QUE SOBROU NO FRASCO DILUENTE NÃO DEVE SER REUTILIZADA.
• Injetando água no frasco de Fuzeon® em pó
A água deve ser acrescentada ao frasco de Fuzeon®. Antes de injetar a água, bata levemente no frasco de Fuzeon® para que o pó se desprenda das paredes do frasco.
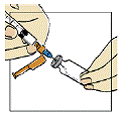
Figura 5
Introduza a agulha da seringa8 com uma leve inclinação através da tampa de borracha do frasco de Fuzeon®. Aperte lentamente o êmbolo35 fazendo com que a água escorra lentamente pela lateral interna do frasco, para evitar a formação de espuma. Depois de acrescentar toda a água, retire a seringa8 do frasco (figura 5).
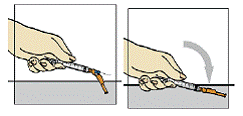
Figura 6
Para proteger a agulha, segure o corpo da seringa8 e pressione o protetor colorido contra a mesa, conforme figura 6. Você ouvirá um clique. Não use a outra mão36 para auxiliá-lo, tão pouco cubra a agulha com a capa incolor, pois você pode se machucar durante essa tentativa. Despreze a seringa8 usada no recipiente fornecido para o descarte das seringas.
• Misturando a água com o pó de Fuzeon®
Para misturar, bata suavemente no frasco de Fuzeon® com um dedo para ajudar a dissolver o pó.
A solução não deve ser agitada nem virada para misturar, porque isto provoca formação de bolhas.
Esfregar o frasco suavemente pode ajudar a misturar.
Aguarde até que o pó se dissolva completamente e que eventuais bolhas restantes desapareçam. Isto habitualmente demora 10 a 20 minutos, mas pode demorar até 45 minutos. É muito importante que todo o pó da droga se dissolva para que seja aplicada a dose. Avalie visualmente a solução e devolva o produto ao profissional de saúde10 antes de usar, caso a solução tenha material particulado. Não deverá haver aderências sólidas nas paredes ou na base do frasco.
Caso persistam bolhas na solução, bata ligeiramente no frasco.
Depois de reconstituído, Fuzeon® deve ser aplicado imediatamente. Você pode preparar um frasco com antecedência ou preparar dois frascos ao mesmo tempo. Neste caso, não se esqueça de utilizar um Kit diferente para cada frasco (água, seringas, agulhas e algodão). O frasco que será usado mais tarde deve ser colocado sob refrigeração de 2º a 8ºC (nunca guarde Fuzeon® na seringa8) logo após a reconstituição, podendo ser usada em até 24 horas. Alguns minutos antes da aplicação, retire o frasco da geladeira já que é necessário que ele fique em temperatura ambiente antes da injeção33.
• Uso de Fuzeon® diluído
Use a seringa8 de segurança de 1 mL.
Proceda com a seringa8 de 1 mL da mesma forma que o orientado nas figuras 1 e 2.
Aspire 1 mL de ar. Cuidado para não ultrapassar a marca limite de 1 mL da seringa8.
Introduza a agulha na tampa de borracha do frasco de Fuzeon®, injete o ar da seringa8 e vire suavemente o frasco.
Mantenha a ponta da agulha abaixo da superfície da solução para evitar bolhas de ar. Puxe o êmbolo35 lentamente até retirar o maior volume possível da solução de Fuzeon®. Cuidado para não ultrapassar a marca limite de 1 mL da seringa8 (figura 7).
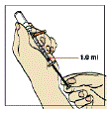
Figura 7
Bata suavemente na seringa8 para fazer com que as bolhas de ar subam para a superfície. Aperte o êmbolo35 para expelir o ar de volta para o frasco, certificando-se de deixar 1 mL de Fuzeon® no corpo da seringa8.
Aplicação
O uso de Fuzeon® é por injeção subcutânea31 (logo abaixo da pele37). O local de injeção33 deve ser rodiziado para evitar injeções repetidas na mesma área. Os locais de injeção33 mais comuns são abdômen, parte anterior da coxa38 e lateral-externa do braço (conforme figura 8). Essas áreas tendem a apresentar mais gordura39 no subcutâneo40 e por isso reduzem o risco de injetar inadvertidamente em local profundo demais (no músculo em vez de sob a pele37), o que pode provocar reações mais severas. Evite a área do abdômen em torno do umbigo41 e áreas que já apresentem reações. Não é recomendável que Fuzeon® seja injetado na face42 (figura 8).
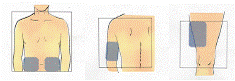
Figura 8
As aplicações da manhã e da noite não devem ser nunca na mesma área.
Limpe a área de injeção33 com o chumaço embebido em álcool e pegue uma prega de pele37.
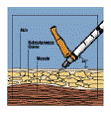
Figura 9
Introduza a agulha na pele37 fazendo um ângulo de 45º com a seringa8.
Ao introduzir metade da agulha na pele37, solte a prega da pele37 e passe a segurar o corpo da seringa8 para evitar que se desloque. Pressione lentamente o êmbolo35 para baixo para injetar Fuzeon® (figura 9).
Após o término da injeção33 de Fuzeon®, para proteger a agulha, segure o corpo da seringa8 e pressione o protetor colorido contra a mesa, conforme figura 6. Você ouvirá um clique. Não use a outra mão36 para auxiliá-lo, tão pouco cubra a agulha com a capa incolor, pois você pode se machucar durante essa tentativa.
Despreze a seringa8 usada no recipiente fornecido para o descarte das seringas.
ATENÇÃO: CUIDADO! DESCARTE AS SERINGAS NO RECIPIENTE FORNECIDO.
É expressamente proibido o descarte das seringas utilizadas e materiais sujos de sangue43 fora dos recipientes plásticos fornecidos em função dos riscos de transmissão do HIV2 e de outras doenças transmissíveis a outras pessoas. O descarte das seringas deve ser feito no recipiente fornecido e, quando atingida a sua capacidade volumétrica, o recipiente deve ser recolhido à unidade de saúde10 mais próxima para a sua completa destruição, conforme orientação de seu médico. Mantenha o recipiente de descarte e o material do kit fora do alcance das crianças.
Caso alguém que o esteja auxiliando a aplicar a medicação, se machuque com a agulha da seringa8 de aplicação (1 mL), ele deve contatar um profissional de saúde10 imediatamente.
Os frascos, tanto de Fuzeon® quanto de água, devem ser utilizados uma única vez. O que sobrar em qualquer um dos frascos deve ser descartado.
Interrupção do tratamento
Não interrompa o tratamento sem o conhecimento de seu médico. Fuzeon® deve ser administrado em conjunto com outros anti-retrovirais para obter melhores resultados.
ADVERTÊNCIA IMPORTANTE:
Uma elevada incidência20 de pneumonia9 bacteriana, algumas vezes fatal, ocorreu em pacientes tratados com Fuzeon® em estudos clínicos. Foram relacionados com um risco maior de pneumonia9 bacteriana os usuários de drogas intravenosas, os fumantes, os pacientes com história de doença pulmonar prévia e aqueles com um baixo número inicial de linfócitos CD4. Estes grupos de pacientes devem ser acompanhados de perto pelo médico, caso apresentem sinais6 e sintomas7 sugestivos de pneumonia9. Informe imediatamente ao seu médico caso surjam sinais6 ou sintomas7 sugestivos de pneumonia9 (tosse, dor no peito44, febre11 ou falta de ar) mesmo que você não se identifique com este grupo de pacientes.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento.
Não interrompa o tratamento sem o conhecimento do seu médico.
Não use o medicamento com o prazo de validade vencido. Antes de usar observe o aspecto do medicamento.
5. REAÇÕES ADVERSAS
Informe o seu médico sobre o aparecimento de reações desagradáveis.
Pacientes adultos
As reações adversas mais comuns relacionadas a Fuzeon® foram as reações no local de injeção33 que, em sua maioria, ocorreram na primeira semana de tratamento e foram associadas a dor leve a moderada ou desconforto no local da injeção33, vermelhidão, endurecimento, surgimento de nódulos e cistos, prurido45 e equimose46. Um pequeno número de reações de hipersensibilidade sistêmica foi associado à terapia com Fuzeon®: rubor, febre11, náuseas12, vômitos13, calafrios14, tremores, hipotensão15, elevação de enzimas hepáticas16, reação primária de imunocomplexos17, distúrbio respiratório e glomerulonefrite18. Foi relatado um caso de Síndrome19 de Guillain-Barré. Observou-se uma incidência20 aumentada de pneumonia9 bacteriana nos estudos clínicos em pacientes tratados com Fuzeon®.
Superdosagem: A maior dose administrada para 12 pacientes em estudos clínicos (estudo T20-501) foi de 180 mg em uma única dose por via subcutânea47. Estes pacientes não apresentaram nenhum evento adverso diferente daqueles encontrados com a dose recomendada. Em estudos de acesso expandido um paciente fez uso de uma dose de 180 mg. Ele também não apresentou nenhum evento adverso novo.
Pacientes pediátricos
Fuzeon® foi estudado em 69 pacientes pediátricos entre 4 e 16 anos de idade com duração de exposição ao Fuzeon® variando de 1 dose para > 48 semanas. As reações adversas observadas durante os estudos clínicos foram similares às observadas em adultos sujeitos ao tratamento.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
Atenção: este é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis para comercialização, efeitos indesejáveis e não conhecidos podem ocorrer. Neste caso, informe ao seu médico.
6. CONDUTA EM CASO DE SUPERDOSE
Não há antídoto48 específico para superdosagem com Fuzeon® e o tratamento deve consistir de medidas gerais de suporte. Não há relatos de superdosagem com Fuzeon® em seres humanos. A maior dose administrada foi de 180 mg em um estudo clínico para 12 pacientes como dose única subcutânea47. Estes pacientes não apresentaram evento adverso que não fosse observado com a dose recomendada. Em estudos de acesso expandido um paciente fez uso de uma dose de 180 mg. Ele também não apresentou nenhum evento adverso novo.
7. CUIDADOS DE CONSERVAÇÃO
Os frascos não abertos de Fuzeon® podem ser armazenados em temperatura ambiente controlada de 15° a 30°C. Se não for possível garantir o controle da temperatura, recomenda-se armazenar sob refrigeração de 2º a 8°C. Caso Fuzeon® não seja injetado imediatamente após ser dissolvido, o mesmo poderá ser usado até, no máximo, 24 horas se mantido sob refrigeração de 2° a 8°C.
Prazo de validade:
Este medicamento possui prazo de validade a partir da data de fabricação (vide embalagem externa do produto). Não tome o medicamento após a data de validade indicada na embalagem, pode ser prejudicial à saúde10.
Os frascos, tanto de Fuzeon® quanto de água, devem ser utilizados uma única vez. O que sobrar em qualquer um dos frascos deve ser descartado.
Todo medicamento deve ser mantido fora do alcance das crianças.
Este medicamento, depois de reconstituído, somente poderá ser utilizado em até 24 horas.


