
REAÇÕES ADVERSAS A MEDICAMENTOS FUZEON
Adultos
O perfil de segurança geral de Fuzeon® está baseado em 2120 pacientes que receberam pelo menos uma dose de Fuzeon® durante vários estudos clínicos. A população de segurança foi composta por 2051 adultos (1181 destes expostos à dose recomendada durante mais de 24 semanas e 631 expostos durante mais de 48 semanas) e por 69 pacientes pediátricos (44 destes expostos à dose recomendada durante mais de 24 semanas e 27 expostos durante mais de 48 semanas).
A análise de segurança primária em adultos está baseada nos resultados combinados de 48 semanas de dois estudos controlados, randomizados, Fase III (TORO-1 e TORO-2) em adultos infectados pelo HIV1-1 com experiência anterior e/ou resistência anterior documentada e/ou intolerância aos inibidores da protease2, inibidores de transcriptase reversa não nucleosídeos e inibidores da transcriptase reversa nucleosídeos. Fuzeon® foi administrado por via subcutânea3 na dose de 90 mg duas vezes ao dia em combinação com terapia anti-retroviral otimizada de base (OB) para 663 pacientes. Um total de 334 pacientes receberam agentes anti-retrovirais otimizados de base isoladamente, como braço controle. Nos estudos TORO 1 e TORO 2, após a 8ª semana de tratamento, os pacientes que estavam no braço controle e que cumprissem os critérios de falência virológica eram permitidos a revisar o regime de anti-retrovirais recomendado e adicionar Fuzeon®. Na semana 48 do estudo, a exposição acumulada a Fuzeon® + OB era de 557 pacientes-ano, e a exposição acumulada no braço controle era de 162 pacientes-ano. Devido a esta diferença na exposição, os resultados de segurança ajustados foram expressos como o número de pacientes com um evento adverso por 100 pacientes-ano de exposição (com exceção das reações em local de injeção4).
Reações de hipersensibilidade
Hipersensibilidade sistêmica
Um pequeno número de relatos de reações de hipersensibilidade sistêmica foram associadas à terapia com Fuzeon®: rubor, febre5, náuseas6, vômitos7, calafrios8, tremores, hipotensão9, elevação de enzimas hepáticas10, reação primária de imunocomplexos11, distúrbio respiratório e glomerulonefrite12. Houve o relato de um caso de Síndrome13 de Guillain-Barré observado nos estudos clínicos. Os pacientes devem ser orientados a descontinuar o tratamento com Fuzeon® e procurar avaliação médica imediatamente, caso desenvolvam sinais14 ou sintomas15 sugestivos de reação de hipersensibilidade. A terapia com Fuzeon® não deve ser reiniciada após sinais14 e sintomas15 consistentes com uma reação de hipersensibilidade relacionada ao uso de Fuzeon®. A eosinofilia16 emergente com o tratamento não foi associada com eventos clínicos de hipersensibilidade.
Reações no local de injeção4
As reações adversas relatadas com maior freqüência após a administração de Fuzeon® foram reações no local de injeção4 (RLIs), que ocorreram em 98% dos 663 pacientes nos estudos TORO-1 e TORO-2 (Tabela 5). Porém, somente 4% dos pacientes descontinuaram o uso de Fuzeon® devido a reações no local de injeção4. A grande maioria das reações no local de injeção4 (85% nos estudos TORO-1 e TORO-2) ocorreu dentro da primeira semana de administração de Fuzeon® e foram relatadas como dor leve a moderada ou desconforto no local de injeção4, sem limitação das atividades usuais. A severidade da dor e do desconforto associada às reações no local de injeção4 não aumentou com a continuação do tratamento. Os sinais14 e sintomas15 que caracterizam as reações no local de injeção4 geralmente duraram até 7 dias e o número de lesões17 evidentes em qualquer uma das visitas do estudo foram iguais ou inferiores a 5 em 72% dos pacientes que apresentavam lesões17 evidentes. As infecções18 no local de injeção4 incluíram abscesso19 e celulite20, ocorrendo em menos de 1,5% dos pacientes.
Tabela 5. Resumo dos sinais14 e sintomas15 individuais caracterizando reações no local de injeção4 nos estudos TORO-1 e TORO-2 combinados (% de pacientes)
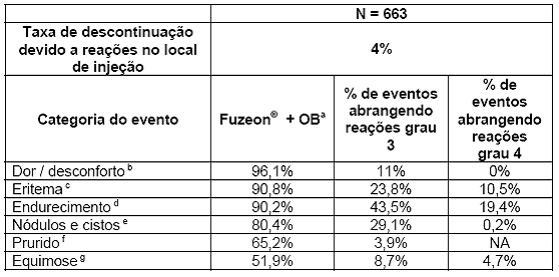
a Qualquer grau de severidade;
b Grau 3 = dor severa requerendo analgésicos21 (ou opióides por ≤ 72 horas) e/ou limitação das atividades usuais; Grau 4 = dor severa requerendo hospitalização ou prolongamento da hospitalização, resultando em morte ou em incapacidade/inabilidade persistente ou significativa, ou em risco de vida clinicamente significativo;
c Grau 3 = ≥ 50 mm porém < 85 mm de diâmetro médio; Grau 4= ≥ 85 mm de diâmetro médio;
d Grau 3 = ≥ 25 mm porém < 50 mm de diâmetro médio; Grau 4= ≥ 50 mm de diâmetro médio;
e Grau 3= ≥ 3 cm; Grau 4 = em caso de drenagem22;
f Grau 3= refratária ao tratamento tópico23 ou requerendo tratamento oral ou parenteral; Grau 4= não definido;
g Grau 3= >3 cm porém ≤ 5 cm; Grau 4= >5 cm;
Foram conduzidos 2 sub-estudos para avaliar os achados anátomo-patológicos nos locais de injeção4. Um dos estudos (Ball R.A. et al) envolveu 7 pacientes HIV1-1+ que auto-administraram Fuzeon® e foram submetidos a biópsias24 excisionais nos locais de aplicação25.
Destes 7 pacientes, 4 deles apresentavam nódulos, 1 com eritema26 e leve enduração, outro com somente enduração e um paciente sem reação visível em local de injeção4. Todas as biópsias24 mostraram eosinofilia16 e degeneração27 do colágeno28. Uma resposta típica de granuloma29 anular ocorreu em 2 pacientes que apresentavam nódulos. Não foram evidenciados casos de vasculite30. O segundo estudo (Myers SA et al) apresentou como achado de biópsia31 um leve infiltrado linfocitário perivascular e intersticial32 em todos os locais de injeção4 de Fuzeon®, inclusive nos tecidos em que não houve a injeção4 de Fuzeon®. Não houve, neste estudo, evidência de vasculite30 ou de granuloma29. Enfermeiras realizaram a aplicação diurna de Fuzeon® o que sugere que a técnica de injeção4 pode ter influência no perfil das reações locais.
Outros eventos adversos
Os eventos adversos mais frequentes reportados em pacientes recebendo Fuzeon® (N = 663), excluindo as reações em local de injeção4 foram diarréia33 (38 pacientes com evento por 100 pacientes-ano) e náuseas6 (27 pacientes com o evento por 100 pacientes-ano). Estes eventos também foram observados em pacientes que receberam apenas o regime otimizado (diarréia33 em 73 pacientes com o evento por 100 pacientes-ano e náuseas6 em 50 pacientes com o evento por 100 pacientes-ano). A adição de Fuzeon® a terapia antiretroviral prévia geralmente não aumentou a frequência ou gravidade da maioria dos eventos adversos.
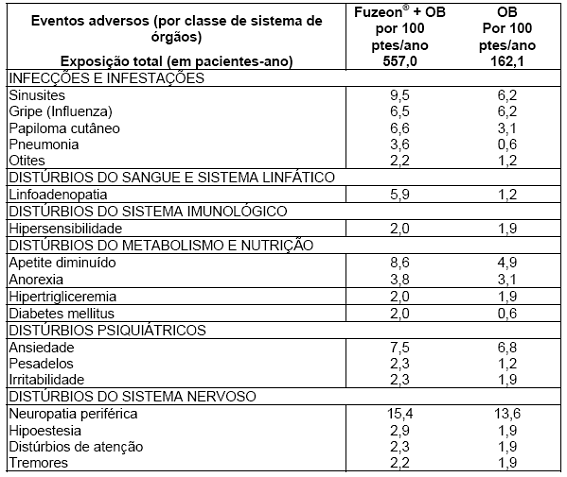
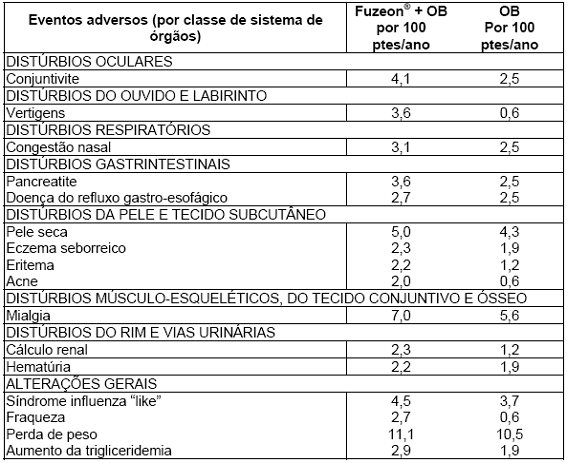
A tabela 6 mostra os eventos que foram mais comuns nos pacientes recebendo Fuzeon® + regime otimizado e nos pacientes do braço controle (regime otimizado apenas), excluindo as reações no local de injeção4, que apresentaram índice de pelo menos 2 pacientes com o evento por 100 pacientes-ano de exposição. Os únicos eventos adversos que foram, com significância estatística, mais comuns no braço com Fuzeon® do que no braço controle foram a pneumonia34 e a linfoadenopatia35.
Tabela 6. Eventos adversos que ocorreram nos pacientes recebendo Fuzeon® + regime otimizado e nos pacientes do braço controle (regime otimizado apenas), excluindo as reações no local de injeção4, que apresentaram índice de pelo menos 2 pacientes com o evento por 100 pacientes-ano de exposição.
Outras Reações Adversas à Droga
Adicionalmente, foi observado um pequeno número de reações de hipersensibilidade atribuídas a Fuzeon® e, em casos raros, ocorreu recorrência36 após a re-introdução do tratamento (vide item Precauções e advertências). Foi observada uma taxa aumentada de pneumonia34 bacteriana em indivíduos tratados com Fuzeon® nos estudos TORO-1 e TORO-2, comparado com o braço controle (6,6 eventos de pneumonia34 por 100 pacientes-ano vs. 0,6 eventos por 100 pacientes-ano, respectivamente). A incidência37 observada em pacientes tratados com Fuzeon® foi consistente com a taxa relatada na literatura para os pacientes desta população. A incidência37 observada nos pacientes do braço controle foi menor do que a taxa relatada na literatura. Os fatores de risco para pneumonia34 incluíram baixa contagem inicial de linfócitos CD4, elevada carga viral inicial, uso de drogas intravenosas, tabagismo e história anterior de doença pulmonar. Não foi esclarecido se a incidência37 aumentada de pneumonia34 estava relacionada ao uso de Fuzeon®. Os pacientes devem ser monitorados estritamente quanto a sinais14 e sintomas15 de infecção38, especialmente se apresentarem condições subjacentes que possam predispor os mesmos à pneumonia34 (vide item Precauções e advertências).
Anormalidades laboratoriais
A maioria dos pacientes não apresentou mudança do grau de toxicidade39 de qualquer parâmetro laboratorial durante o estudo. A Tabela 7 mostra as anormalidades laboratoriais decorrentes do tratamento, que ocorreram em pelo menos 2 pacientes por 100 pacientes-ano de exposição e que ocorreram mais frequentemente (como graus 3 ou 4) em pacientes recebendo Fuzeon®, nas avaliações dos estudos TORO-1 e TORO-2 após 48 semanas. A eosinofilia16 decorrente do tratamento (contagem de eosinófilos40 maior do que o limite superior da normalidade de 0,7 x 109/L) ocorreu com incidência37 maior em pacientes com Fuzeon® + OB (12,9 pacientes por 100 pacientes-ano) comparado com o braço controle OB (5,6 pacientes por 100 pacientes-ano). Quando analisado apenas eosinofilia16 alta (> 1,4 x 109/L), o índice de exposição ajustado é similar nos dois grupos (2,2 e 1,8 pacientes com o evento por 100 pacientes-ano no braço com Fuzeon® e no braço controle, respectivamente).
Tabela 7. Anormalidades laboratoriais graus 3 e 4 que ocorreram em pacientes tratados com Fuzeon® e com OB apenas, que ocorreram em pelo menos 2 pacientes por 100 pacientes-ano de exposição, na avaliação combinada dos estudos TORO-1 e TORO-2.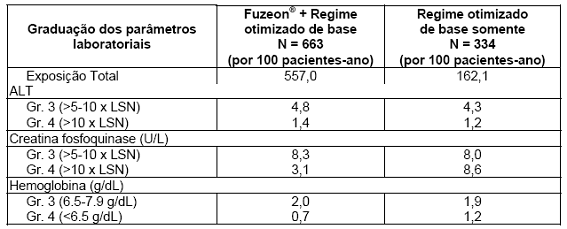
Eventos Adversos adicionais
Os seguintes eventos adversos ou anormalidades laboratoriais foram reportados nas análises de 24 semanas dos estudos TORO-1 e TORO-2 como ocorrendo em mais que 2% dos pacientes ou mais frequentemente nos pacientes recebendo Fuzeon®: candidíase41 oral, herpes simples, foliculites, insônia, depressão, tonturas42, distúrbios no paladar43, cefaléia44, tosse, dor na região superior do abdômen, constipação45, dor de garganta46, prurido47, sudorese48 noturna, sudorese48 excessiva, astenia49, aumentos da gamaGT, amilase, lipase e AST. A relação causal destes eventos com Fuzeon® não foi estabelecida.
Pediátricos
Fuzeon® foi estudado em 69 pacientes pediátricos entre 4 e 16 anos de idade com duração de exposição ao Fuzeon® variando de 1 dose para > 48 semanas. As reações adversas observadas durante os estudos clínicos foram similares às observadas em adultos sujeitos ao tratamento.
Atenção: este é um medicamento novo e, embora as pesquisas tenham indicado eficácia e segurança aceitáveis para comercialização, efeitos indesejáveis e não conhecidos podem ocorrer. Neste caso, informe ao seu médico.
11. SUPERDOSE
Não há antídoto50 específico para superdosagem com Fuzeon® e o tratamento deve consistir de medidas gerais de suporte. Não há relatos de superdosagem com Fuzeon® em seres humanos. A maior dose administrada foi de 180 mg em um estudo clínico para 12 pacientes como dose única subcutânea3. Estes pacientes não apresentaram evento adverso que não fosse observado com a dose recomendada. Em estudos de acesso expandido um paciente fez uso de uma dose de 180 mg. Ele também não apresentou nenhum evento adverso novo.
12. ARMAZENAGEM
Os frascos não abertos de Fuzeon® podem ser armazenados em temperatura ambiente controlada de 15º a 30°C. Se não for possível garantir o controle da temperatura, recomenda-se armazenar sob refrigeração de 2º a 8°C. Caso Fuzeon® não seja injetado imediatamente após ser dissolvido, o mesmo poderá ser usado até, no máximo, 24 horas se mantido sob refrigeração de 2° a 8°C.
Prazo de validade:
Este medicamento possui prazo de validade a partir da data de fabricação (vide embalagem externa do produto). Não tome o medicamento após a data de validade indicada na embalagem, pode ser prejudicial à saúde51.
Os frascos, tanto de Fuzeon® quanto de água, devem ser utilizados uma única vez. O que sobrar em qualquer um dos frascos deve ser descartado.
Este medicamento, depois de reconstituído, somente poderá ser utilizado em até 24 horas.
MS-1.0100. 0617
Farm. Resp.: Guilherme N. Ferreira - CRF-RJ nº 4288
Fabricado na Suíça por F. Hoffmann-La Roche Ltd., Basiléia ou
Fabricado para F. Hoffmann-La Roche Ltd., Basiléia, Suíça
por Roche Diagnostics GmbH, Mannheim, Alemanha
Embalado por: F. Hoffmann-La Roche Ltd., Kaiseraugst, Suíça ou Ivers-Lee AG, Burgdorf, Suíça.
Importado e distribuído no Brasil por:
Produtos Roche Químicos e Farmacêuticos S.A.
Est. dos Bandeirantes, 2020 CEP 22710-104 - Rio de Janeiro /RJ
CNPJ 33.009.945/0023-39
Serviço Gratuito de Informações – 0800 7720 289 R
www.roche.com.br
USO SOB PRESCRIÇÃO MÉDICA COM RETENÇÃO DA RECEITA.
ATENÇÃO – O USO INCORRETO CAUSA RESISTÊNCIA DO VÍRUS52 DA AIDS E FALHA NO TRATAMENTO.
PROIBIDA A VENDA AO COMÉRCIO
N° do lote, data de fabricação, prazo de validade: vide cartucho.
CDS 3.0E


