
RESULTADOS DE EFICÁCIA FUZEON
Estudos com pacientes submetidos a tratamento anti-retroviral anterior
Os estudos T20-301 (TORO-1) e T20-302 (TORO-2) encontram-se em andamento, sendo estudos randomizados, controlados, abertos, multicêntricos em pacientes infectados com HIV1-1, com pelo menos 3 a 6 meses de tratamento anterior com inibidores de transcriptase reversa nucleosídeos e não nucleosídeos e inibidores da protease2. Todos os pacientes receberam um regime otimizado de base (OB), consistindo de 3 a 5 agentes anti-retrovirais selecionados com base na história anterior do paciente, como também nas avaliações de resistência viral genotípica e fenotípica3 no baseline. Os pacientes foram randomizados na proporção de 2:1 para Fuzeon® (90 mg SC duas vezes ao dia) + OB ou somente OB.
Os estudos TORO-1 e TORO-2 são bastante similares na população de pacientes estudada, desenho, critérios de seleção de pacientes (com exceção da duração prévia de exposição aos antiretrovirais e número de inibidores de protease), condução, monitoramento e planejamento das análises. Desta forma a análise conjunta dos dados dos dois estudos foi prospectivamente planejada. Os resultados da análise de 48 semanas são apresentados, portanto, de forma combinada possibilitando a análise de uma amostra maior e uma estimativa mais precisa nas diferenças de tratamento do grupo com e sem Fuzeon®.
As características demográficas combinadas da população de intenção de tratamento (ITT) dos pacientes incluídos nos estudos TORO-1 e TORO-2 estão demonstrados na Tabela 1. Os pacientes foram previamente expostos a uma mediana de 12 anti-retrovirais, por um tempo mediano de 7 anos.
Tabela 1. Estudo TORO-1 e TORO – 2 – Demografia combinada dos pacientes (ITT)

As mudanças na semana 48 em relação ao baseline dos estudos TORO-1 e TORO-2 combinados estão resumidas na Tabela 2 e todas foram significantemente maiores no grupo de tratamento com Fuzeon®.
Tabela 2. Estudos TORO–1 e TORO–2 – Resultados combinados do tratamento controlado, randomizado4 na semana 48 (ITT†)
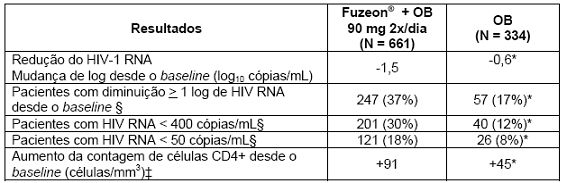
†ITT- Recebeu tratamento e teve pelo menos 1 acompanhamento pós RNA do baseline.
*Estatisticamente significante p < 0.05
‡ Último valor observado
§Descontinuação e falha virológica = falha. Duas visitas consecutivas para confirmar a resposta virológica.
A proporção de pacientes que alcançaram uma carga viral menor que 400 cópias/mL até a semana 48 foi de 30% entre os pacientes no regime com Fuzeon® + OB, comparado com 12% entre os pacientes que receberam apenas regime otimizado (Tabela 2).
A análise do tempo de falha virológica está demonstrada na Figura 11. O tempo médio para falha virológica no grupo com Fuzeon® + OB foi de 32 semanas, significativamente maior do que no grupo com OB apenas (11 semanas).
Figura 11 – Análise do tempo de falha virológica dos estudos TORO 1 e 2 combinados até a semana 48 (população intenção de tratamento - ITT).
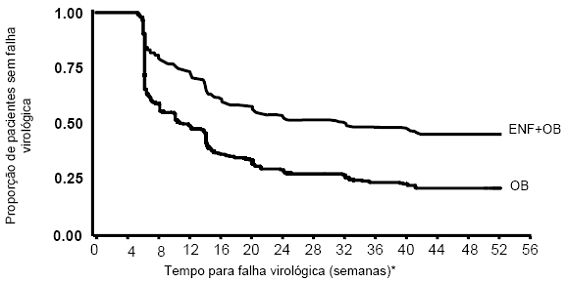
*Definição de falha virológica pelo protocolo (baseado em 2 medidas consecutivas): redução menor que 0,5log10 HIV1-1 RNA do baseline até a semana 8; redução menor 1.0 log10 HIV1-1 RNA até a semana 16; aumento maior ou igual a 1.0 log10 HIV1-1 RNA após resposta de, pelo menos, 2.0 log10 HIV1-1 RNA.
Os resultados dos estudos também foram analisados em subgrupos, e a terapia com Fuzeon® foi associada a uma maior proporção de pacientes que alcançaram HIV1-1 RNA menor que 400 cópias/mL em todos os subgrupos; baseado na contagem de CD4+ no baseline, baseado na medida de HIV1-1 RNA no baseline; pelo número prévio de anti-retrovirais e pelo número de antiretrovirais ativos no regime otimizado. No entanto, pacientes com CD4+ > 100 células5/mL, HIV1-1 RNA inicial < 5.0 log10 cópias/mL, experiência com menos de 10 anti-retrovirais prévios e uma ou mais drogas ativas no regime anti-retroviral foram mais propensos a alcançar uma carga viral menor que 400 cópias/mL em ambos os tratamentos (Tabela 3).
Tabela 3. Proporção de pacientes que atingiram HIV1-1 RNA menor que 400 cópias/mL na semana 48 por subgrupo (estudos TORO-1 e TORO-2, ITT*)
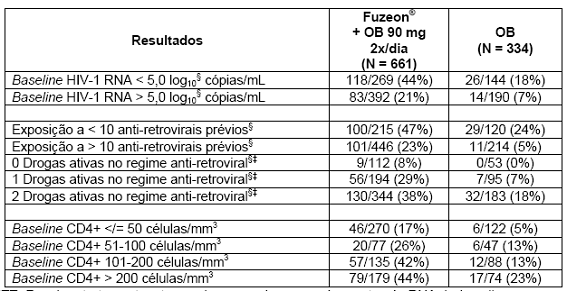
*ITT- Recebeu tratamento e teve pelo menos 1 acompanhamento pós RNA do baseline
§Descontinuação e falha virológica = falha. Duas visitas consecutivas para confirmar a resposta virológica
‡ - Baseado no escore GSS
Uso pediátrico
Dados limitados de eficácia do Fuzeon® estão disponíveis para crianças acima de 3 anos de idade.
O estudo T20-204 é um estudo aberto e multicêntrico que avalia a atividade antiviral, segurança e farmacocinética do Fuzeon® em 14 pacientes pediátricos com idade de 3 à 12 anos e experiência com no máximo 2 classes de antiretrovirais registrados(1).
No estudo T20-2004 pacientes receberam ou 30 ou 60 mg/m2/dose de Fuzeon® duas vezes ao dia associados ao seu regime anti-retroviral de base. Após 7 dias, seus regimes de tratamento de base foram alterados para 3 novos ou anti-retrovirais sensíveis e a dosagem de Fuzeon® foi continuada. Os pacientes tinham uma idade média de 8 anos de idade (variando de 3,7 a 11,9 anos). A linha de base média da contagem de células5 CD4 foi 523 células5/μL e a linha de base média de RNA HIV1-1 foi 4,4 log10 c/mL. Seguindo análise da atividade antiviral, farmacocinética e segurança no dia 7, todos exceto 1 paciente mudaram para uma dose de Fuzeon® de 60 mg/m2/dose. A mudança média da linha de base de RNA HIV1-1 em 7 dias foi 1,15 log10 cópias/mL para 10 crianças recebendo a dose de 60 mg/m2 (1, 2).
Todos exceto 3 pacientes completaram 48 semanas de terapia crônica. Na semana 48, 6/14 (43%) dos pacientes tinha declínio na RNA HIV1-1 > 1 log10 e 4/14 (29%) dos pacientes estavam abaixo de 400 cópias/mL de RNA HIV1-1. As mudanças médias da linha de base (para a população considerada como tratada) na contagem de células5 CD4 e RNA HIV1-1 foram 237 células5/μL e 1,24 log10 c/mL respectivamente (3).
Referências Bibliográficas
1. Carlyon T
Paediatric Use summary of T-20 / Ro 29-9800.
Research Report No. 1008730. 2002. MRN 9015
2. Roberts N
Final Study Report - Preclinical virology / Pharmacology summary for Enfuvirtide.
Research Report No. 1007534. 2002. MRN 9009
3. Chen J, Hughes M
PACTG 1005: A Phase I/II Study of T-20, a Fusion Inhibitor, in HIV1-1 Infected Children. Part B.
Dose-escalating Chronic Dosing study.
Final Statistical Report of Safety and Activity Data.
Statistical and Data Management Center, Pediatric AIDS Clinical Trials Group.
July 29, 2003; pp. 14-20


